En mann i 50-årene utviklet enterokolitt med påfølgende elektrolytt- og proteintap, immunsvikt og alvorlige infeksjoner. Diagnosen er sjelden og alvorlig.
En mann i 50-årene var tidligere behandlet for residiverende bilateral iridosyklitt og skleritt med prednisolon 17,5 mg daglig og metotreksat 20 mg injeksjon ukentlig. Fire år før det aktuelle fikk han påvist kronisk lymfatisk leukemi / småcellet lymfocytært lymfom på bakgrunn av tilfeldig oppdaget lymfeknutesvulst på halsen. Ett år før det aktuelle viste hudbiopsi av nytilkomne pigmenterte plakk under øynene funn som var forenlig med nekrobiotisk xantogranulom (figur 1).
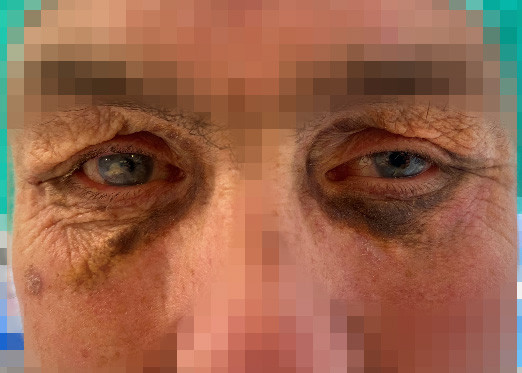
Nekrobiotisk xantogranulom er en ikke-Langerhans-celle histiocytose som er assosiert med lymfoproliferative sykdommer (1). Symptomene er ofte subkutane knuter eller plakk i huden, hvor opptil 80 % av tilfellene er lokalisert periorbitalt. Ekstrakutane manifestasjoner som keratitt, uveitt og skleritt er beskrevet (1). Det finnes ingen klare retningslinjer for behandling av tilstanden, og i de fleste tilfeller er behandlingen rettet mot eventuell underliggende lymfoproliferativ sykdom (2).
Pasientens øyeplager ble oppfattet som sekundære til hans lymfom, og det ble funnet indikasjon for lymfomrettet behandling. I forkant av behandlingsoppstart viste benmargsbiopsi små lommer med 90 % infiltrasjon av kronisk lymfatisk leukemi, og væskestrømscytometri viste 65 % kronisk lymfatisk leukemi-celler. Det ble i tillegg påvist M-komponent av type IgG-kappa på 0,4 g/L. Det ble startet kjemoimmunterapi med rituksimab 375 mg/m2 intravenøst på dag 1 og bendamustin 90 mg/m2 intravenøst på dag 1 og 2, med planlagt kurintervall hver 28. dag. Metotreksat var på dette tidspunktet seponert, og prednisolon var trappet ned til 10 mg daglig.
En måned etter oppstart av kjemoimmunterapi ble pasienten innlagt ved lokalsykehus med feber, oppkast og diaré. Han var ikke tidligere operert i buken, hadde ingen kjent tarmsykdom, og det forelå ingen reiseanamnese eller familieanamnese for inflammatorisk tarmsykdom. Pasienten benektet bruk av ikke-steroide antiinflammatoriske midler. Blodprøver viste C-reaktivt protein (CRP) på 40 mg/L (referanseområde < 5), mens leukocyttnivået var innenfor normalområdet. Etter å ha sikret blodkulturer, urindyrkning og avføringsprøve ble det startet med benzylpenicillin 3 g × 4 og gentamicin 6 mg/kg × 1 intravenøst.
Lymfomrettet kjemoimmunterapi gir økt risiko for infeksjoner, oftest bakterielle. Pasientene blir informert om å oppsøke sykehus ved temperatur > 38,3 grader ved enkeltmåling eller vedvarende temperatur > 38,0 grader mellom behandlingene (3). Symptomer som oppkast og diaré, i kombinasjon med feber, behøver ikke nødvendigvis indikere infeksjoner med utgangspunkt i mage-tarm-kanalen, men kan også være uspesifikke (toksiske) symptomer på sepsis.
Dagen etter innleggelse forelå en positiv undersøkelse av polymerasekjedereaksjon (PCR) for norovirus i avføring, mens blodkulturer, avførings- og urindyrkning var sterile. Pasienten var afebril med normalt leukocyttnivå og avtakende oppkast og diaré. Etter fire døgn ble antibiotika seponert, og pasienten ble utskrevet i velbefinnende.
Pasienten ble innlagt tre døgn senere med redusert allmenntilstand, magesmerter og vanntynne tømminger. Ved innleggelsen var han afebril med normale vitale parametre. Blodprøver viste CRP på 12 mg/L med normale nivåer av leukocytter, kreatinin på 59 μmol/L (60–105), estimert glomerulær filtrasjonsrate (eGFR) på 108 mL/min og normale elektrolytter. Blodkulturer og avføringsprøver ble sikret, sistnevnte var negative for Clostridioides difficile og tarmpatogenpanel. Dyrkningsprøver for Aeromonas, Vibrio og Plesiomonas i avføring var negative. Pasienten utviklet økende smerter i nedre del av buken, og det ble rekvirert CT-undersøkelse av abdomen og bekken to dager etter innleggelse som viste uttalt enterokolitt med inflammasjon i hele tynntarmen og høyre del av tykktarmen (figur 2). Dagen etter ble det anlagt fekalkatetersystem i rektum for avlasting av uttalt sår hud rundt endetarmsåpningen, og pasienten fikk parenteral ernæring og elektrolyttsubstitusjon. Fire dager etter innleggelse viste PCR-undersøkelse for cytomegalovirus (CMV) i EDTA-plasma < 110 IE/mL (svak positiv).
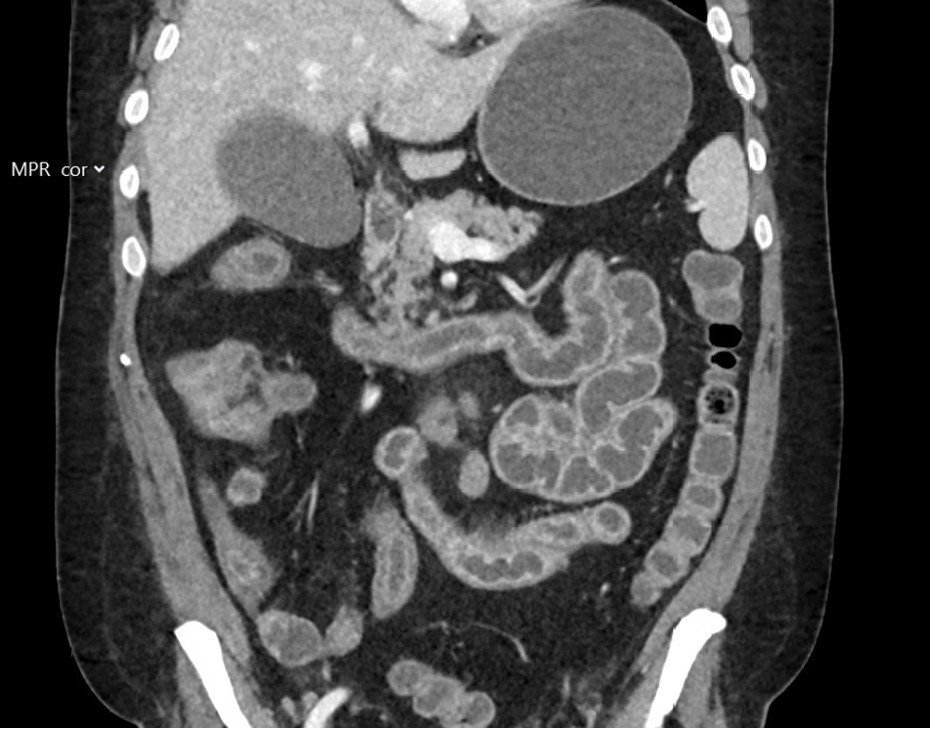
Cytomegalovirus er et vanlig forekommende herpesvirus. Primærinfeksjonen forløper asymptomatisk for de fleste immunkompetente personer, deretter etableres cytomegalovirus som latent infeksjon med potensial for reaktivering. Hos immunkompetente kontrolleres reaktivering av immunforsvaret. Hos immunsupprimerte kan cytomegalovirus forårsake alvorlig sykdom, både ved primærinfeksjon og reaktivering (4). CMV-kolitt er en av de hyppigst forekommende manifestasjonene, hvor magesmerter, diaré, feber, fatigue og vekttap er vanlige symptomer (4, 5). Diagnosen mistenkes ved typisk klinisk bilde og makroskopiske funn ved endoskopi (inflammasjon, ødem og ulcerasjoner). Den bekreftes ved typiske histopatologiske funn, som store celler med inklusjonslegemer, og ved påvisning av CMV-infiserte celler med immunhistokjemisk farging (4). Påvisning av CMV-DNA i biopsier og blod kan være et supplement til standard diagnostikk, men er ikke alene diagnostisk (4). CMV-DNA kan påvises i biopsier og blod også hos pasienter som ikke har CMV-sykdom, og det kan være fraværende hos pasienter som har CMV-sykdom (4).
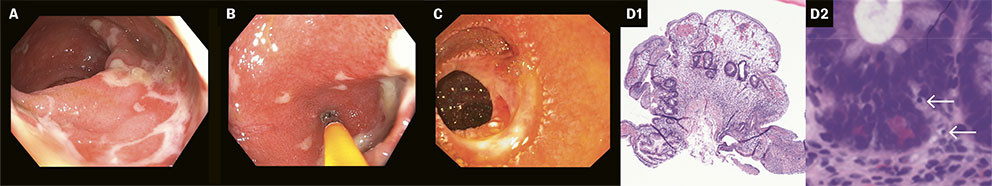
Syv døgn etter innleggelse viste koloskopi inflammasjon av terminale ileum og ødematøs slimhinne med utviskede kartegninger gjennom hele tykktarmens forløp. Det var også tegn til dyptgående ulcerasjoner i rektosigmoidovergangen (figur 3a og 3b). Biopsier fra tynn- og tykktarm til mikrobiologi og histologi viste CMV-DNA i rektumbiopsi. Tilstanden ble tolket som CMV-enterokolitt, og det ble startet behandling med ganciclovir 5 mg/kg × 2 intravenøst.
Det er vanlig å skille mellom CMV-infeksjon med CMV-DNA i blod eller i biopsi hos asymptomatiske pasienter, og CMV-sykdom med CMV-DNA i blod eller biopsi hos pasienter med samtidig kliniske manifestasjoner. Det kan være vanskelig å skille CMV-sykdom fra andre årsaker til kolitt basert på det endoskopiske bildet og histologiske funn. Reaktivering av CMV med påfølgende viremi kan skje som følge av annen inflammasjon, og påvisning av CMV-DNA indikerer ikke nødvendigvis behandlingstrengende sykdom (4, 6). Det er stor variasjon mellom ulike PCR-tester, og derfor er det ikke definert noen grense for mengde CMV-DNA som indikerer sykdom (4).
Histopatologisk svar på tynn- og tykktarmsbiopsier viste ulcerasjoner, akutt betennelse og reaktive kryptforandringer. Immunhistokjemisk analyse av biopsi fra rektum var CMV-negativ. Det forelå ikke holdepunkter for CMV-kolitt på grunn av fravær av inklusjonslegemer, og heller ikke for inflammatorisk tarmsykdom. Ganciclovirbehandlingen ble kontinuert på grunn av antatt CMV-reaktivering. Pasienten fikk total parenteral ernæring, og hadde persisterende diaré med elektrolyttavvik og fibrinavleiringer i fekalkatetersystem. Behandling med loperamid og kolestyramin var uten effekt på diaréen, og forsøk med opiumsdråper ga økte magesmerter. Gastroskopi og øvre ballong-enteroskopi, utført to og en halv uke etter innleggelse, viste inflammert slimhinne en meter fra pylorus og stedvise fibrotiske drag (figur 3c). Biopsier fra duodenal- og jejunalslimhinne viste totteatrofi og akutt betennelse, men immunhistokjemi var negativ for cytomegalovirus og Helicobacter pylori, samt negativ serologi og histologi for cøliaki. Prøve til PCR-undersøkelse for Tropheryma whipplei var negativ. CT-undersøkelse av toraks, abdomen og bekken, utført 15 dager etter innleggelse, viste økende utbredelse av enterittforandringer i jejunum med veggfortykkelse og fettvevssløring, uten tegn til øvrige infeksjonsfokus. Etter rådføring med spesialist i fordøyelsessykdommer ved universitetssykehuset ble det startet med intravenøs methylprednisolon 60 mg × 1 daglig.
Kortikosteroider har en viktig plass i behandlingen av alvorlige former for inflammatorisk tarmsykdom, også i behandlingen av kjemoterapi-assosiert kolitt og immunmediert kolitt (7).
Kortikosteroidbehandlingen hadde ingen frapperende effekt på magesmerter, diaré eller inflammasjonsparametre, og ble nedtrappet over tre uker. På bakgrunn av vedvarende forhøyede inflammasjonsparametre, uten andre mikrobiologiske funn enn et betydelig nivå av CMV-DNA i EDTA-plasma (9 346 IE/mL), ble behandlingen med ganciclovir kontinuert. To måneder etter innleggelsen utviklet pasienten feber med rektaltemperatur på 38,5 grader, CRP på 100 mg/L med normale leukocytter og vekst av E. coli i blodkulturer, men ikke i urin. Han fikk behandling med piperacillin/tazobactam 4 g/0,5 g × 4 intravenøst i ti døgn.
To og en halv måned etter innleggelsen hadde pasienten utviklet alvorlig hypoalbuminemi med albumin < 10 g/L (35–43) og ødemer, som ble behandlet med regelmessige albumininfusjoner intravenøst. Det var ingen albuminuri, og årsaken ble antatt å være proteintap fra tarmen i kombinasjon med katabolisme som følge av redusert næringsinntak og inflammasjon. På bakgrunn av magesmerter ved sondeernæring var det vedvarende behov for parenteral ernæring og bruk av smertepumpe. Pasienten hadde på dette tidspunktet redusert nyrefunksjon med eGFR på 40, basert på måling av Cystatin-C på 1,67 mg/L (0,61–1,01). Dette var sannsynligvis betinget i hypovolemi og langvarig behandling med ganciklovir.
Tre måneder etter innleggelse ble det igjen konferert med spesialist i fordøyelsessykdommer ved universitetssykehuset. Man mistenkte nå at pasientens behandlingsrefraktære enterokolitt skyldtes tidligere rituksimabinfusjon, og det ble foreslått behandling med TNF-α-hemmere. I samråd med pasienten og hans pårørende ble behandling med infliksimab 10 mg/kg × 1 intravenøst hver 14. dag initiert. Pasientens øyesymptomer hadde opphørt til tross for kun én enkelt kur med bendamustin og rituksimab. I etterkant av behandlingen med infliksimab ble det observert gradvis avtakende magesmerter, fallende inflammasjonsparametre og normalisering av konsistens og farge på avføringen.
Rituksimab-indusert enterokolitt er en sjelden og potensielt alvorlig tilstand hvor patofysiologien ikke er klarlagt. Tilstanden kan både klinisk og histologisk minne om inflammatorisk tarmsykdom (8). I litteraturen er det kun kasuistisk beskrevet effekt av blant annet seponering av rituksimab, behandling med kortikosteroider, TNF-α-hemmere samt kolektomi (9). Pasienten hadde tidligere forsøkt kortikosteroider uten effekt og hadde affeksjon av store deler av tynntarmen, slik at kolektomi ikke ble ansett som aktuelt.
På femte dag etter behandlingen med infliksimab utviklet pasienten igjen feber og stigende inflammasjonsparametre med CRP på 197 mg/L (< 5). Blodkulturer viste oppvekst av Enterococcus faecium, og det ble startet behandling med vankomycin 20 mg/kg × 2 intravenøst. Grunnet alvorlig hypogammaglobulinemi med IgG 3,49 g/L (6,10–14,9) og residiverende infeksjoner, fikk pasienten substituert intravenøst immunglobulin. Videre behandling med infliksimab ble utsatt på bakgrunn av pågående infeksjon. Etter ti dagers vankomycinbehandling var pasienten afebril med sterile blodkulturer. Etter grundig utredning ble det ikke funnet holdepunkt for infeksiøs eller hematologisk årsak til pasientens symptomer. Det var observert klinisk og biokjemisk respons etter første dose med infliksimab, og man kontinuerte behandlingen to uker etter første dose. Biopsier fra tarmslimhinnen ble regransket ved universitetssykehuset, som konkluderte med rituksimab-indusert enterokolitt (figur 3d). Det ble ikke påvist infeksiøse agens ved spesialfarging. Det forelå heller ikke holdepunkt for amyloidose eller lymfom i tarmen, og undersøkelse med in situ-hybridisering for Epstein-Barr-virus var negativ. To uker etter den andre dosen, etter totalt fire måneders sykehusopphold, utviklet pasienten på ny febrilia og stigende inflammasjonsparametre med Enterococcus faecium i blodkulturer. Han var avkreftet, somnolent, desorientert, og hadde generalisert ødem, forverret nyresvikt, alvorlig hypernatremi og moderat hypokalemi. På bakgrunn av funn av Pseudomonas aeruginosa i luftveissekret, ble det startet behandling med linezolid 600 mg × 2 og meropenem 1 g × 3 intravenøst. Tre døgn senere var pasienten ukontaktbar uten tegn til bedring, og man valgte i samråd med pårørende å konvertere til lindrende behandling. Pasienten sovnet stille inn dagen etter. Obduksjonsrapporten konkluderte med uttalte kroniske betennelsesforandringer og ulcerasjoner, forenlig med rituksimab-indusert enterokolitt. Immunhistokjemisk undersøkelse påviste en enkelt CMV-positiv celle i tynntarmen, men det er usikkert hvilken klinisk relevans funnet har, ettersom det også var påvist rituksimab-indusert enterokolitt. Tarmen var sannsynligvis utgangspunktet for avdødes sepsiser. Melding om alvorlig medikamentbivirkning ble sendt til Direktoratet for medisinske produkter, som bekreftet årsakssammenhengen mellom fatal enterokolitt og rituksimab som sannsynlig.
Diskusjon
Rituksimab er et monoklonalt antistoff rettet mot det transmembrane antigenet CD20, som er lokalisert på B-lymfocytter. Det brukes i behandlingen av non-Hodgkins lymfom og en rekke autoimmune sykdommer. Det tolereres som regel godt, men bivirkninger som feber, kvalme, oppkast og infeksjoner kan forekomme (10).
Rituksimab-indusert enterokolitt er en sjelden tilstand med under 40 publiserte tilfeller på verdensbasis. Skademekanismen er ikke klarlagt, men det er foreslått at den skyldes uttømming av B-lymfocytter i tarmveggen, med sekundær immundysregulering og aktivering av T-lymfocytter, som medfører tarmbetennelse (8, 9). En retrospektiv studie fra 2019 anslo frekvensen på utvikling av kolitt blant kreftpasienter som mottok behandling med rituksimab til 4 %, med en gjennomsnittlig behandlingslengde på 99 dager. Hovedandelen av pasientene utviklet symptomer på kolitt åtte måneder etter første behandling (11). Studien konkluderte med at det ikke forelå en sikker korrelasjon mellom kolitt og underliggende immunsuppressiv tilstand (11). En islandsk studie fra 2021 viste at pasienter behandlet med rituksimab – uavhengig av behandlingsindikasjon, dose og behandlingsvarighet – hadde seks ganger større sjanse for å utvikle inflammatorisk tarmsykdom sammenlignet med normalbefolkningen (12). Det ble ikke funnet en assosiasjon med samtidig autoimmun sykdom (12).
Det er ikke beskrevet rituksimab-indusert enterokolitt etter administrasjon av kun én enkelt dose rituksimab, og det er forfatternes mening at behandlingsindikasjonen kronisk lymfatisk leukemi / småcellet lymfocytært lymfom alene ikke spilte en rolle. Pasienter med underliggende autoimmun sykdom, malignitet eller tidligere immunsuppressiv behandling har nedsatt immunforsvar, noe som i seg selv kan øke risikoen for immundysregulering. Dette kan gjøre tarmslimhinnen mer mottakelig for betennelse eller reaktivering av latente infeksjoner i mage-tarm-kanalen, og potensielt øke risikoen for utvikling av rituksimab-indusert enterokolitt (8, 9). Det er vanskelig å skjelne mellom kausalitet og koinsidens, samt å identifisere spesifikke risikofaktorer som gjør pasienter mer utsatt for utvikling av rituksimab-indusert enterokolitt.
Det eksisterer ingen retningslinjer for håndtering av tilstanden, men i litteraturen er det beskrevet tilfeller hvor kortikosteroider og TNF-α-hemmere har vært brukt med suksess. I noen alvorlige tilfeller har det vært behov for kolektomi og/eller proktektomi (8). Behandling med rituksimab medfører immunsuppresjon, og ytterligere behandling med kortikosteroider eller TNF-α-hemmere øker risikoen for opportunistiske infeksjoner. Behandlingen av rituksimab-indusert enterokolitt blir derfor en vanskelig balanse mellom immunsuppressiv behandling og risikoen for infeksjoner (8).
Pasienten i sykehistorien hadde et alvorlig og behandlingsrefraktært forløp, hvor den diagnostiske forsinkelsen hovedsakelig skyldtes at symptomene først ble oppfattet som CMV-enterokolitt. Det ble senere konkludert med at det var tilkommet CMV-reaktivering, men ikke CMV-sykdom. Symptomene oppstod i etterkant av kjemoimmunterapi gitt mot en hematologisk sykdom, men nivået av M-komponent var fallende, og gjentatte CT-undersøkelser viste verken økende eller nytilkommet lymfeknutesvulst. Det var kun gitt én enkelt behandlingsserie med kjemoimmunterapi kort tid før symptomdebut, noe som bidro til at mistanken om legemiddelbivirkning som årsak var lav.
Under oppholdet var det i tre tilfeller oppvekst i blodkulturer, noe som trolig representerte bakteriell translokasjon fra tarmen på grunn av svekket barrierefunksjon og nedsatt immunforsvar. Først ved regranskning av tarmbiopsiene fant man holdepunkt for en rituksimab-indusert enterokolitt. Behandling med TNF-α-hemmer var da allerede igangsatt og hadde medført midlertidig bedring, men videre behandling ble komplisert av alvorlige infeksjoner, elektrolyttforstyrrelser, hypoalbuminemi, nyresvikt og underernæring. Tidligere behandling med infliksimab kunne kanskje ha minimert risikoen for ytterligere immunsuppresjon tilført av kortikosteroider, med påfølgende CMV-reaktivering og bakteriemier.
Konklusjon
Rituksimab-indusert enterokolitt er en sjelden tilstand som ikke tidligere er beskrevet i Norge. Bruken av rituksimab i Norge har vært økende de siste årene (13). Man bør være oppmerksom på tilstanden dersom pasienter utvikler vedvarende magesmerter og diaré under behandling med rituksimab.
Pasientens pårørende har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Chakari W, Rangatchew F, Toyserkani NM et al. Necrobiotic xanthogranuloma misdiagnosed as a planocellular carcinoma. Ugeskr Laeger 2019; 181: V11180800. [PubMed]
- 2.
Miguel D, Lukacs J, Illing T et al. Treatment of necrobiotic xanthogranuloma - a systematic review. J Eur Acad Dermatol Venereol 2017; 31: 221–35. [PubMed]
- 3.
Helsedirektoratet. Lymfekreft - handlingsprogram. https://www.helsedirektoratet.no/retningslinjer/lymfekreft-handlingsprogram Lest 28.10.2024.
- 4.
Dioverti MV, Razonable RR. Cytomegalovirus. Microbiol Spectr 2016; 4: 4.4.20. [PubMed][CrossRef]
- 5.
Baniak N, Kanthan R. Cytomegalovirus Colitis: An Uncommon Mimicker of Common Colitides. Arch Pathol Lab Med 2016; 140: 854–8. [PubMed]
- 6.
Griffiths P, Reeves M. Pathogenesis of human cytomegalovirus in the immunocompromised host. Nat Rev Microbiol 2021; 19: 759–73. [PubMed][CrossRef]
- 7.
Schneider BJ, Naidoo J, Santomasso BD et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol 2021; 39: 4073–126. [PubMed][CrossRef]
- 8.
Martinez Perez P, Hanna L, Jaynes E et al. Infliximab rescue therapy in a case of severe granulomatous colitis associated with rituximab use. BMJ Case Rep 2024; 17: e257729. [PubMed][CrossRef]
- 9.
Lipka S, Katz S, Crawford JM. Fulminant Colitis Following Rituximab Therapy. Gastroenterol Hepatol (N Y) 2016; 12: 58–60. [PubMed]
- 10.
Gürcan HM, Keskin DB, Stern JNH et al. A review of the current use of rituximab in autoimmune diseases. Int Immunopharmacol 2009; 9: 10–25. [PubMed][CrossRef]
- 11.
Mallepally N, Abu-Sbeih H, Ahmed O et al. Clinical Features of Rituximab-associated Gastrointestinal Toxicities. Am J Clin Oncol 2019; 42: 539–45. [PubMed][CrossRef]
- 12.
Kristjánsson VB, Lund SH, Gröndal G et al. Increased risk of inflammatory bowel disease among patients treated with rituximab in Iceland from 2001 to 2018. Scand J Gastroenterol 2021; 56: 46–52. [PubMed][CrossRef]
- 13.
Folkehelseinstituttet. Legemiddelforbruket i Norge 2019-2023. https://www.fhi.no/contentassets/b0802ad9303347b682cf6a8fa701ec91/legemiddelforbruket-i-norge-2019-2023-rapport-2024.pdf Lest 12.11.2024.