Background
Invasive pneumococcal disease (IPD) can be prevented with serotype-specific vaccines. The level of protection depends on which serotypes are in the vaccine and which serotypes are circulating. The purpose of this study was to describe how the epidemiology of IPD has changed since the introduction of the pneumococcal vaccine in the Childhood Immunisation Programme in Norway in 2006, and how the epidemiology impacts the choice of vaccine for older patients.
Material and method
The study is based on cases of IPD in Norway in the period 2004–23, as reported to the Norwegian Surveillance System for Communicable Diseases (MSIS).
Results
A total of 13,767 cases of IPD were reported during the study period. In the < 5 years age group, the incidence rate decreased from 28.9 (per 100,000) in 2004 to 8.6 in 2023, representing a reduction of 70 % (incidence rate ratio 0.3 (95 % confidence interval (CI) 0.2–0.4)). In the ≥ 65 years age group, the incidence rate fell from 78.0 to 35.2, corresponding to a reduction of 55 % (incidence rate ratio 0.5 (95 % CI 0.4–0.5)). After 2014, the five most common serotypes in the ≥ 65 years age group were 22F, 3, 8, 9 N and 23B.
Interpretation
Despite an indirect effect from the Childhood Immunisation Programme, there remains a residual disease burden of IPD in older patients that can be prevented through vaccination. The 23-valent polysaccharide vaccine and the 20- and 21-valent conjugate vaccines cover most serotypes that cause IPD in older patients.
Hovedfunn
Forekomsten av invasiv pneumokokksykdom i aldersgruppen ≥ 65 år falt med 55 % i perioden 2004–23. Noen få serotyper forårsaket mer enn halvparten av sykdomstilfellene i aldersgruppen ≥ 65 år. I perioden 2015–23 dekket den 23-valente polysakkaridvaksinen 64–72 % av sykdomstilfellene med påvist serotype i aldersgruppen ≥ 65 år.
Invasiv pneumokokksykdom kan ha et brutalt forløp med raskt progredierende sepsis og død innen få dager, selv med korrekt behandling (1). Pneumokokker (Streptococcus pneumoniae) er også en hovedårsak til infeksjoner i de nedre luftveiene hos eldre (2). Pneumokokksykdom rammer oftest de yngste og de eldste, samt personer med svekket immunforsvar (2). Bakterien er vanlig forekommende i nasofarynksen hos barn, som er den viktigste smittekilden (3). Den er omgitt av en polysakkaridkapsel, som er bakteriens viktigste virulensfaktor, og deles inn i mer enn 100 ulike serotyper basert på kapseltypen (4). Serotypene har ulike sykdomsfremkallende egenskaper, og det er variasjon i hvilke serotyper som forekommer i ulike aldersgrupper og geografiske områder (5).
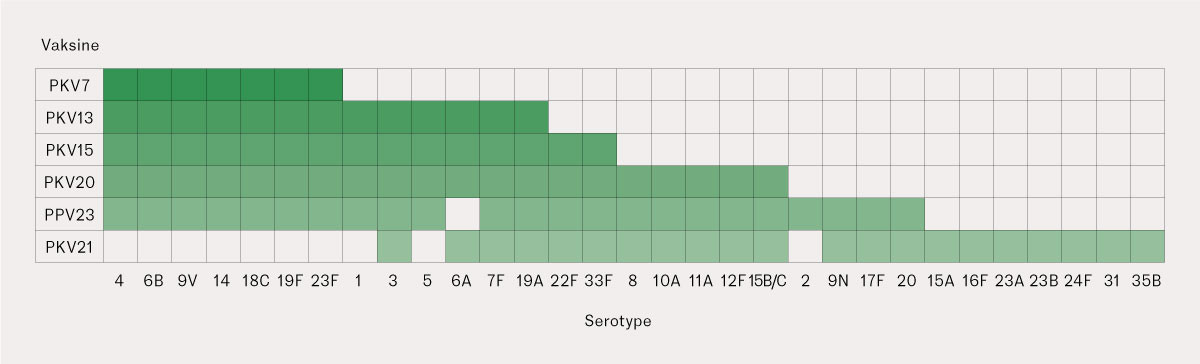
De tilgjengelige pneumokokkvaksinene er serotypespesifikke, noe som innebærer at de kun forebygger sykdom mot de serotypene som inngår i vaksinen. Det finnes i dag to ulike typer pneumokokkvaksiner: pneumokkpolysakkaridvaksine og pneumokokkonjugatvaksine (6). Konjugatvaksinene induserer antistoffer hos barn under to år og kan derfor gis til spedbarn. De induserer også slimhinneimmunitet. Det påvirker bærerskap og immunologisk hukommelse, noe som gir en lengre varighet av beskyttelsen. Polysakkaridvaksinen mangler disse egenskapene, men har sin styrke i en bredere serotypedekning og beskytter mot 23 ulike serotyper (PPV23, Pneumovax®). I 2006 ble konjugatvaksine tatt inn i det norske barnevaksinasjonsprogrammet som en vaksine mot syv serotyper (PKV7, Prevenar®). I 2011 ble den erstattet av en vaksine mot 13 serotyper (PKV13, Prevenar13®). Sistnevnte ble godkjent for bruk hos voksne i 2015. I 2022 ble to nye konjugatvaksiner med bredere serotypedekning godkjent for bruk hos voksne: én mot 15 (PKV15, Vaxneuvance®) og én mot 20 serotyper (PKV20, Apexxnar/Prevenar20®). Begge har senere blitt godkjent for bruk på barn. En konjugatvaksine mot 21 serotyper (PKV21, Capvaxive®) ble godkjent for bruk hos voksne i USA sommeren 2024 og forventes godkjent i Europa våren 2025.
Med flere nye vaksiner til bruk hos eldre, er det nødvendig å vurdere hvordan disse skal brukes. Formålet med studien var å undersøke forekomsten av invasiv pneumokokksykdom i Norge fra 2004 til 2023, og hvilken betydning epidemiologien har for valg av vaksine til eldre.
Materiale og metode
Dette er en registerstudie med data fra Meldingssystem for smittsomme sykdommer (MSIS) fra alle meldte tilfeller med invasiv pneumokokksykdom i Norge i perioden 1.1.2004 til 31.12.2023 (studieperioden omfatter pneumokokkonjugatvaksinering i barnevaksinasjonsprogrammet fra 2006 og hos voksne fra 2015, derav delperioden 2015–23).
Dataene ble kategorisert etter meldingsår og serotype, samt aldersgruppert på bakgrunn av vaksineanbefalingene: < 5 år, 5–64 år (ingen generell pneumokokkvaksineanbefaling) og ≥ 65 år.
Invasiv pneumokokksykdom ble definert som S. pneumoniae påvist i sterilt prøvemateriale, vanligvis blod eller cerebrospinalvæske (7). Et referanselaboratorium (Folkehelseinstituttet) utførte serotyping (fenotypisk metode med Quellungs reaksjon, og fra 2018 med en genotypisk metode basert på sekvenseringsdata) og resistensbestemmelse.
Pneumokokkserotype ble kategorisert etter vaksinetype (pneumokkpolysakkaridvaksine, pneumokokkonjugatvaksine eller ingen vaksine) og videre underkategorisert etter hvilke(n) vaksine(r) serotypen inngikk i (figur 1).
Vaksinetype-, serotype- og aldersspesifikke insidensrater ble beregnet basert på antall meldte tilfeller med invasiv pneumokokksykdom i ulike aldersgrupper per 100 000 per kalenderår. Ved manglende data om serotype antok vi at fordelingen blant personer uten data var den samme som blant de med data. Befolkningsdata for beregning av insidensrater ble hentet fra Statistisk sentralbyrå (8). For å sammenligne insidensrater mellom ulike år, benyttet vi insidensrateratio med 95 % konfidensintervall, beregnet i R med eksakt tosidig binomial test.
Data var utlevert aggregert og anonymisert med hjemmel i § 19 i helseregisterloven, jf. MSIS-forskriften § 4-1 andre ledd.
Resultater
Det ble meldt 13 767 tilfeller av invasiv pneumokokksykdom i studieperioden, hvorav 12 967 (94 %) var serotypet.
Insidensrater
I aldersgruppen < 5 år falt insidensraten (alle serotyper) fra 28,9 i 2004 til 8,6 i 2023 (figur 2a), noe som tilsvarer en reduksjon på 70 % (insidensrateratio 0,3 (95 % KI 0,2–0,4)). Insidensraten forårsaket av serotyper som inngikk i PKV7, falt fra 20,8 i 2004 til ingen tilfeller i 2023, og for de seks serotypene som ble lagt til i PKV13 i 2011, falt insidensraten fra 6,3 i 2011 til 1,9 i 2023.
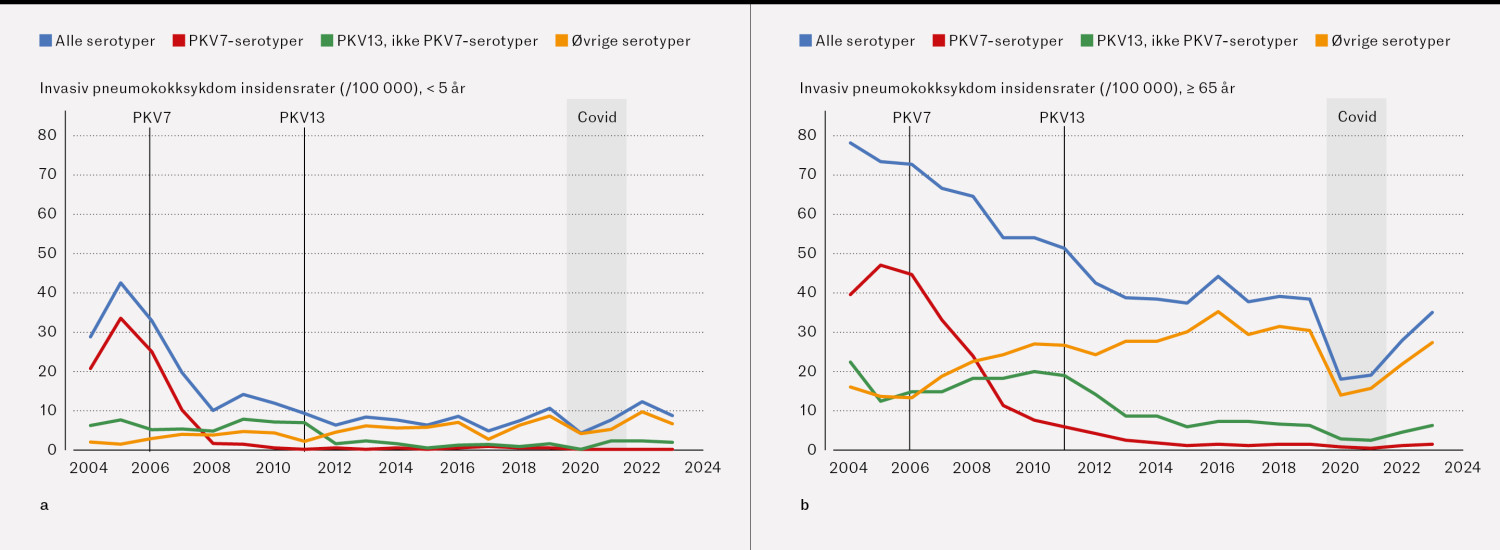
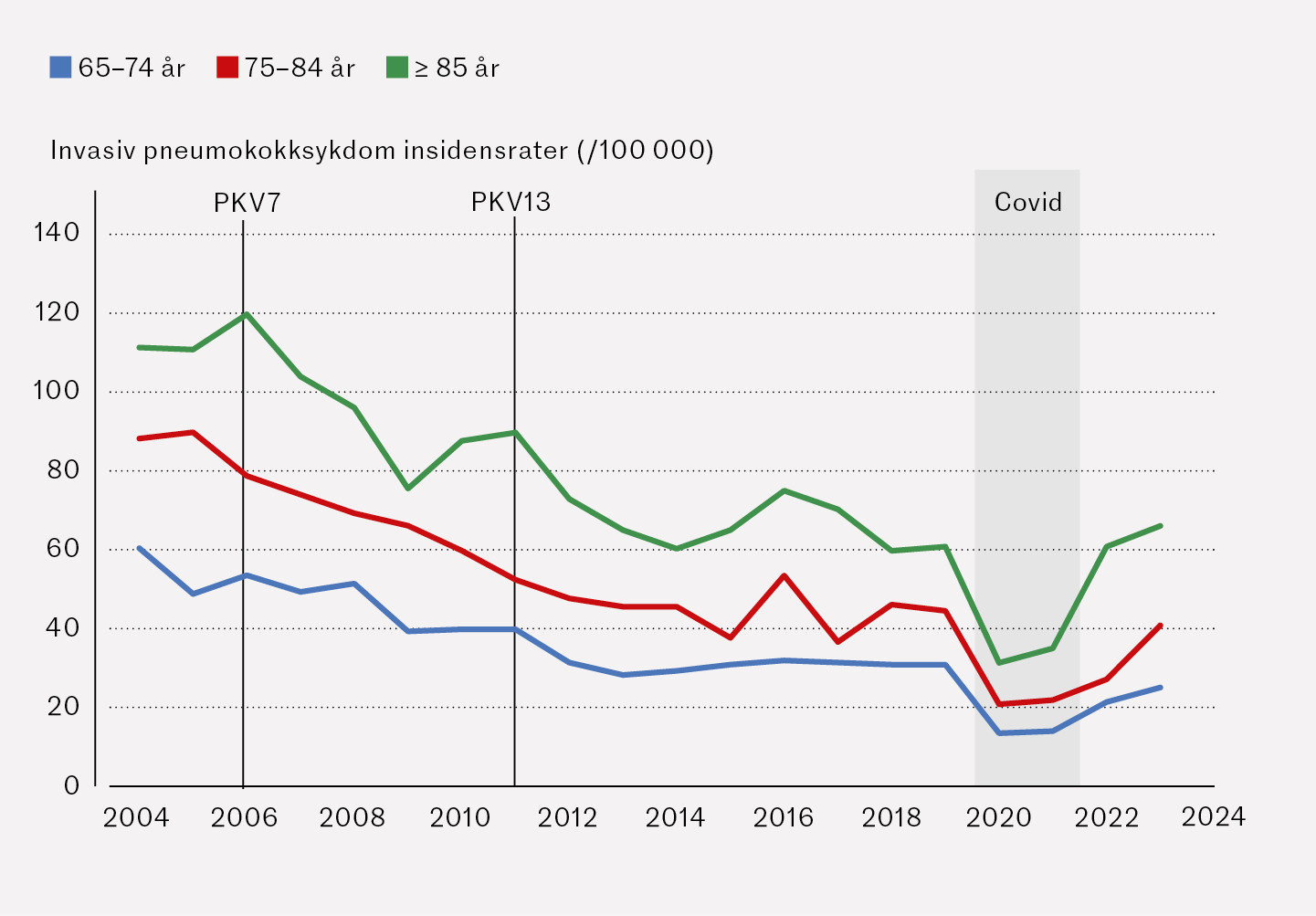
I aldersgruppen ≥ 65 år falt insidensraten (alle serotyper) fra 78,0 i 2004 til 35,2 i 2023, noe som tilsvarer en reduksjon på 55 % (insidensrateratio 0,5 (95 % KI 0,4–0,5) (figur 2b). Insidensraten forårsaket av serotyper som inngikk i PKV7, falt fra 39,6 i 2004 til 1,6 i 2023, og for de seks serotypene som ble lagt til i PKV13 i 2011, falt insidensraten fra 11,4 i 2011 til 6,1 i 2023. Insidensraten forårsaket av serotyper som ikke inngikk i vaksinene i barnevaksinasjonsprogrammet, steg fra 16,2 i 2004 til 27,3 i 2023. Insidensratene hos eldre var høyest for aldersgruppen 85 år og eldre (figur 3).
Serotypefordeling 2015–23
I delperioden ble det meldt 4 649 tilfeller med invasiv pneumokokksykdom (tabell 1). 2 712 (58 %) var blant personer ≥ 65 år, og 203 (4 %) var i aldersgruppen < 5 år.
Tabell 1
Meldte tilfeller av invasiv pneumokokksykdom per år i Norge i perioden 2015–23, fordelt på aldersgrupper.
| År | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | Total |
|---|---|---|---|---|---|---|---|---|---|---|
| Meldte tilfeller (N) | 522 | 599 | 560 | 594 | 609 | 294 | 319 | 539 | 613 | 4 649 |
| Aldersgruppe | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) |
| < 5 år | 19 (4) | 26 (4) | 14 (3) | 22 (4) | 31 (5) | 12 (4) | 21 (7) | 34 (6) | 24 (4) | 203 (4) |
| 5–64 år | 191 (37) | 196 (33) | 215 (38) | 221 (37) | 223 (37) | 112 (38) | 114 (36) | 229 (42) | 233 (38) | 1 734 (37) |
| ≥ 65 år | 312 (60) | 377 (63) | 331 (59) | 351 (59) | 355 (58) | 170 (58) | 184 (58) | 276 (51) | 356 (58) | 2 712 (58) |
4 516/4 649 (97 %) var serotypet. I aldersgruppen ≥ 65 år varierte andelen serotyper som inngikk i PKV13-vaksinen mellom 17 og 22 % for de ulike årene (tabell 2). Til sammenligning var andelen med PKV15-, PKV20- og PPV23-serotyper henholdsvis 30–45 %, 54–63 % og 64–72 %, og for PKV21-serotyper (p.t. ikke-godkjent vaksine) 82–89 %.
Tabell 2
Meldte tilfeller av invasiv pneumokokksykdom per år i Norge i perioden 2015–23 i aldersgruppen ≥ 65 år forårsaket av serotyper som inngår i ulike vaksiner.
| År | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | Total |
|---|---|---|---|---|---|---|---|---|---|---|
| Meldte tilfeller (N) | 312 | 377 | 331 | 351 | 355 | 170 | 184 | 276 | 356 | 2 712 |
| Serotyper1 som inngår i | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) |
| PKV13-vaksine | 61 (20) | 74 (20) | 74 (22) | 68 (19) | 71 (20) | 37 (22) | 31 (17) | 58 (21) | 78 (22) | 552 (20) |
| PKV15-vaksine | 141 (45) | 170 (45) | 142 (43) | 136 (39) | 136 (38) | 62 (36) | 55 (30) | 108 (39) | 148 (42) | 1 098 (40) |
| PKV20-vaksine | 189 (61) | 232 (62) | 197 (60) | 203 (58) | 204 (57) | 92 (54) | 102 (55) | 163 (59) | 223 (63) | 1 605 (59) |
| PKV21-vaksine | 260 (83) | 313 (83) | 294 (89) | 287 (82) | 296 (83) | 147 (86) | 156 (85) | 234 (85) | 298 (84) | 2 285 (84) |
| PPV23-vaksine | 200 (64) | 247 (66) | 232 (70) | 227 (65) | 241 (68) | 123 (72) | 122 (66) | 188 (68) | 246 (69) | 1 826 (67) |
1Antall serotyper korresponderer med tallet i vaksinebetegnelsen. De ulike vaksinene har til dels overlappende serotypedekning, og prosent er beregnet av totalt antall meldte tilfeller for det aktuelle året.
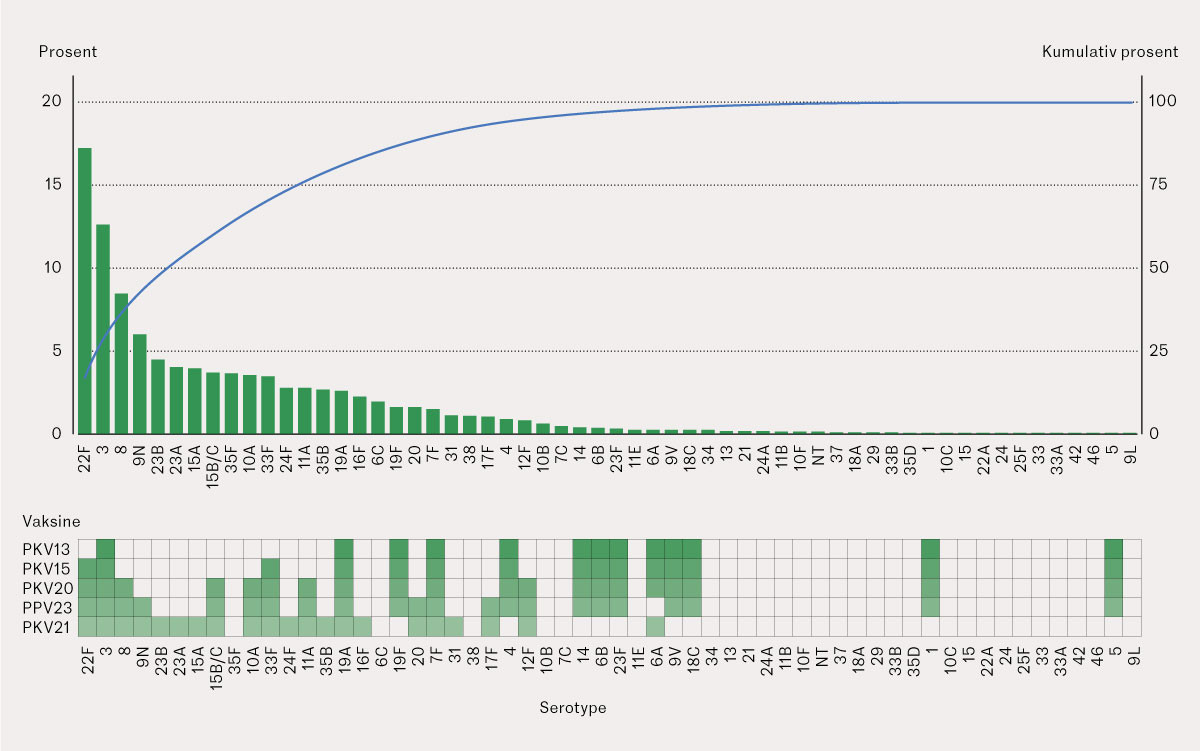
Serotypene 22F, 3, 8, 9 N og 23B var de fem hyppigste serotypene og utgjorde 47 % av tilfellene i aldersgruppen ≥ 65 år i perioden 2015–23 (figur 4). De øvrige var forårsaket av 51 andre serotyper, hvorav 16 var opphav til 1–2 sykdomstilfeller hver.
Diskusjon
Innføringen av pneumokokkvaksine i det norske barnevaksinasjonsprogrammet i 2006 har ført til en betydelig reduksjon i forekomsten av invasiv pneumokokksykdom hos barn og eldre i studieperioden (2004–23). Det er godt dokumentert at vaksinering av barn har gitt en indirekte beskyttelse i eldre aldersgrupper (9, 10). Til tross for den betydelige reduksjonen av invasiv pneumokokksykdom forårsaket av serotyper som inngår i vaksinene i barnevaksinasjonsprogrammet, har den totale insidensraten hos eldre vært relativt stabil i perioden 2015–23 (med unntak av en markant forbigående nedgang i covid-19-årene 2020 og 2021). Utflatingen skyldes en økning i sykdom forårsaket av serotyper som ikke inngår i PKV13, såkalt serotypeerstatning. Det samsvarer med erfaringene fra andre land med godt etablerte PKV13-vaksinasjonsprogram, selv om omfanget av serotypeerstatning varierer (9–11). Vaksinasjonsdekningen for pneumokokkvaksine i barnevaksinasjonsprogrammet har vært høy i mange år, og var 95 % i 2023 (12). Det kan se ut som den maksimale indirekte effekten av PKV13 er nådd, og det er usikkert om det kan forventes ytterligere reduksjon av invasiv pneumokokksykdom hos eldre uten andre forebyggende tiltak. Mange tilfeller kan forebygges ved vaksinasjon, men kun 30 % i aldersgruppen ≥ 65 år har de siste årene vært vaksinert i tråd med retningslinjene til Folkehelseinstituttet (13). I statsbudsjettet for 2025 har regjeringen foreslått å innføre et voksenvaksinasjonsprogram som inkluderer pneumokokkvaksine, etter anbefaling fra Folkehelseinstituttet (14). Dette vil forhåpentligvis øke vaksinasjonsdekningen i den eldre befolkningen.
I en nylig publisert artikkel viser Eldholm og kollegaer hvordan genomet til pneumokokkbakterien har utviklet seg i Norge over de siste 40 årene (15). Ved fylogenetisk analyse fant de at flere linjer skiftet kapseltype fra vaksineserotype til ikke-vaksineserotype før introduksjonen av pneumokokkvaksine i barnevaksinasjonsprogrammet, men at ekspansjonen av disse linjene først skjedde etter at pneumokokkvaksine ble tatt i bruk. Som i vår studie, viser de at pneumokokkvaksine i barnevaksinasjonsprogrammet har ført til en reduksjon av invasiv pneumokokksykdom hos både barn og voksne, men i motsetning til oss har de ikke kvantifisert reduksjonen eller sett på serotypefordelingen hos eldre i relasjon til de nye vaksinene.
Et fåtall serotyper er årsak til en stor andel av sykdomstilfellene, mens det er stor spredning i serotyper blant de øvrige tilfellene. Dette samsvarer med observasjoner i andre land (11, 16). De fleste serotyper som inngår i PKV13-vaksinen, har blitt sjeldne, Det er imidlertid fortsatt en restsykdomsbyrde fra PKV13, særlig hos eldre, som i stor grad er forårsaket av serotype 3. Serotype 3 skiller seg fra andre serotyper ved at den har en tykk kapsel omgitt av et slimlag, som gir den et karakteristisk slimete utseende og evnen til å motstå vaksineinduserte antistoffer (17). Den største utfordringen hos eldre er likevel serotyper som ikke inngår i PKV13-vaksinen, og den er derfor lite egnet til bruk hos eldre. Av vaksinene som har vært godkjent i studieperioden, er det PPV23 som har dekket flest serotyper, etterfulgt av PKV20. Differansen i serotypedekning mellom de to vaksinene har variert, fra 18 prosentpoeng i 2020 til 6 prosentpoeng i 2023. Forskjellen skylles hovedsakelig variasjon i forekomsten av serotype 9 N, som dekkes av PPV23, men ikke PKV20. Når differansen mellom PPV23 og PKV20 er så lav som 6 prosentpoeng, vil PKV20 være et relevant alternativ på grunn av de immunologiske fordelene, som lengre varighet av immunitet.
De første konjugatvaksinene ble utviklet med tanke på serotypeepidemiologien hos barn. Nyere vaksiner, som PKV15 og PKV20, har i stor grad lagt utvalgte serotyper til allerede eksisterende vaksiner for å gi bredere beskyttelse. PKV21 er derimot utviklet spesielt med tanke på serotypeepidemiologien hos voksne. Voksne vil da beskyttes gjennom både indirekte effekt fra barnevaksinasjonsprogrammet og direkte beskyttelse fra vaksine med en annen serotypedekning. De siste årene har serotypene inkludert i PKV21 utgjort 84–85 % av sykdomstilfellene. Når PKV21 blir godkjent i Europa, vil den være en relevant pneumokokkvaksine for den eldre befolkningen.
I denne studien har vi kun undersøkt invasiv pneumokokksykdom, ettersom denne er meldingspliktig, i motsetning til ikke-invasiv pneumokokksykdom. Ikke-invasiv pneumokokkpneumoni er mindre alvorlig enn invasiv sykdom, men utgjør en langt større sykdomsbyrde. S. pneumoniae er den vanligste årsaken til samfunnservervet pneumoni, til tross for utfordringer knyttet til diagnostikk (18, 19). En norsk studie har estimert at tre av fire pneumokokkpneumonier var ikke-bakteriemiske (20). Vi har ikke norske data på serotypefordelingen ved ikke-bakteriemiske pneumonier, men en kanadisk studie fant at fordelingen av de vanligste serotypene holdt seg relativt konstant mellom invasiv- og ikke-invasiv pneumokokkpneumoni (18). Beskyttelse mot ikke-bakteriemisk pneumokokkpneumoni er et viktig argument for vaksinasjon, ettersom sykdomsbyrden er høy.
I en tidligere systematisk gjennomgang av effekten til PPV23 og PKV13 hos eldre konkluderte vi med at begge gir opp mot 70 % beskyttelse mot invasiv pneumokokksykdom, men at PKV13 ser ut til å gi noe bedre beskyttelse mot serotypene som inngår i begge vaksinene (21). Effekten mot ikke-invasiv sykdom er lavere. Effekten til PPV23 avtar i løpet av få år etter vaksinasjon, mens effekten til PKV13 ser ut til å vedvare i minst fem år. PKV15, PKV20 og PKV21 er godkjent på bakgrunn av immunogenisitetsdata som viser at de induserer en immunrespons på linje med tidligere godkjente vaksiner, men så vidt vi vet er det ennå ikke publisert data om deres effekt mot klinisk sykdom.
Konklusjon
Til tross for en god indirekte effekt fra barnevaksinasjonsprogrammet, er det fortsatt en restsykdomsbyrde av invasiv pneumokokksykdom hos eldre som kan forebygges gjennom vaksinasjon. For eldre bør man velge en vaksine som dekker de serotypene som forårsaker sykdom i denne aldersgruppen. Basert på data fra de siste årene, vil vaksinene PPV23, PKV20 og PKV21 (forventes godkjent våren 2025) være mest aktuelle.
Artikkelen er fagfellevurdert.
- 1.
Holm AM, Berild D, Ringertz SH et al. Occurrence and clinical presentation of systemic pneumococcal infections in an unselected population in Oslo, Norway, between 1993 and 1997. Eur J Clin Microbiol Infect Dis 2002; 21: 465–7. [PubMed][CrossRef]
- 2.
Ortqvist A, Hedlund J, Kalin M. Streptococcus pneumoniae: epidemiology, risk factors, and clinical features. Semin Respir Crit Care Med 2005; 26: 563–74. [PubMed][CrossRef]
- 3.
Vestrheim DF, Høiby EA, Aaberge IS et al. Impact of a pneumococcal conjugate vaccination program on carriage among children in Norway. Clin Vaccine Immunol 2010; 17: 325–34. [PubMed][CrossRef]
- 4.
Ganaie F, Saad JS, McGee L et al. A New Pneumococcal Capsule Type, 10D, is the 100th Serotype and Has a Large cps Fragment from an Oral Streptococcus. MBio 2020; 11: e00937-20. [PubMed][CrossRef]
- 5.
Grabenstein JD, Musey LK. Differences in serious clinical outcomes of infection caused by specific pneumococcal serotypes among adults. Vaccine 2014; 32: 2399–405. [PubMed][CrossRef]
- 6.
WHO. Considerations for pneumococcal vaccination in older adults. Wkly Epidemiol Rec 2021; 23: 217–28.
- 7.
Folkehelseinstituttet. Meldingskriterier for sykdommer i MSIS. https://www.fhi.no/publ/informasjonsark/meldingskriterier-for-sykdommer-i-msis/ Lest 8.1.2025.
- 8.
Statistikkbanken SSB. Befolkning etter alder, kjønn og år. https://www.ssb.no/statbank/table/10211/ Lest 8.1.2025.
- 9.
Bennett JC, Deloria Knoll M, Kagucia EW et al. Global impact of ten-valent and 13-valent pneumococcal conjugate vaccines on invasive pneumococcal disease in all ages (the PSERENADE project): a global surveillance analysis. Lancet Infect Dis 2024; S1473-3099(24)00665-0. [PubMed][CrossRef]
- 10.
Hanquet G, Krizova P, Dalby T et al. Serotype Replacement after Introduction of 10-Valent and 13-Valent Pneumococcal Conjugate Vaccines in 10 Countries, Europe. Emerg Infect Dis 2022; 28: 137–8. [PubMed][CrossRef]
- 11.
van der Linden M, Imöhl M, Perniciaro S. Limited indirect effects of an infant pneumococcal vaccination program in an aging population. PLoS One 2019; 14: e0220453. [PubMed][CrossRef]
- 12.
Bentdal YE, Berild JD, Bergsaker MR et al. Barnevaksinasjonsprogrammet i Norge. Rapport for 2023. https://www.fhi.no/publ/2024/barnevaksinasjonsprogrammet-i-norge.-rapport-for-2023 Lest 27.1.2025.
- 13.
Folkehelseinstituttet. Nasjonalt vaksinasjonsregister SYSVAK. https://www.fhi.no/va/sysvak/ Lest 8.1.2025.
- 14.
Nymark LS, Winje BA, Berild JD et al. Pneumokokkvaksine til eldre som vaksinasjonsprogram. https://www.fhi.no/publ/2023/pneumokokkvaksine-til-eldre-som-vaksinasjonsprogram/ Lest 27.1.2025.
- 15.
Eldholm V, Osnes MN, Bjørnstad ML et al. A genome-based survey of invasive pneumococci in Norway over four decades reveals lineage-specific responses to vaccination. Genome Med 2024; 16: 123. [PubMed][CrossRef]
- 16.
Amin-Chowdhury Z, Collins S, Sheppard C et al. Characteristics of Invasive Pneumococcal Disease Caused by Emerging Serotypes After the Introduction of the 13-Valent Pneumococcal Conjugate Vaccine in England: A Prospective Observational Cohort Study, 2014-2018. Clin Infect Dis 2020; 71: e235–43. [PubMed][CrossRef]
- 17.
Luck JN, Tettelin H, Orihuela CJ. Sugar-Coated Killer: Serotype 3 Pneumococcal Disease. Front Cell Infect Microbiol 2020; 10: 613287. [PubMed][CrossRef]
- 18.
LeBlanc JJ, ElSherif M, Ye L et al. Recalibrated estimates of non-bacteremic and bacteremic pneumococcal community acquired pneumonia in hospitalized Canadian adults from 2010 to 2017 with addition of an extended spectrum serotype-specific urine antigen detection assay. Vaccine 2022; 40: 2635–46. [PubMed][CrossRef]
- 19.
Rozenbaum MH, Pechlivanoglou P, van der Werf TS et al. The role of Streptococcus pneumoniae in community-acquired pneumonia among adults in Europe: a meta-analysis. Eur J Clin Microbiol Infect Dis 2013; 32: 305–16. [PubMed][CrossRef]
- 20.
Lyngstad TM, Kristoffersen AB, Winje BA et al. Estimation of the incidence of hospitalization for non-invasive pneumococcal pneumonia in the Norwegian population aged 50 years and older. Epidemiol Infect 2022; 150: 1–21. [PubMed][CrossRef]
- 21.
Winje BA, Berild JD, Vestrheim DF et al. Efficacy and effectiveness of pneumococcal vaccination in elderly - a second update of the literature. https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2019/pneumococcal-vaccines-in-elderly-publisert.pdf Lest 27.1.2025.