Background
Allogeneic stem cell transplantation (ASCT) has the potential to cure patients with lymphoma when conventional treatment fails, but it is associated with a risk of serious complications. We present treatment outcomes after two years for 120 patients who underwent ASCT in the period 1 January 2011–30 September 2021.
Material and method
The study consists of patients who underwent their first transplant at Oslo University Hospital. Several changes were made to the transplantation protocols during this period, including the introduction of prophylaxis against graft-versus-host disease (GVHD) with antithymocyte globulin in October 2016. Comparisons were made of survival and complications for patients transplanted in the period 1 January 2011–30 September 2016 (group 1: 65 patients) and 1 October 2016–30 September 2021 (group 2: 55 patients).
Results
After two years, 42/65 (65 %) of patients in group 1 and 39/55 (71 %) of patients in group 2 were alive. Transplantation-related mortality was 18/65 (28 %) in group 1 and 8/55 (15 %) in group 2. Five patients in group 1 and seven patients in group 2 died following a relapse. One patient in group 2 died from an unknown cause. A total of 13/65 (20 %) in group 1 and 4/55 (7 %) in group 2 developed severe acute GVHD. Among patients who survived at least 100 days, 24/61 (39 %) in group 1 and 3/51 (6 %) in group 2 developed severe chronic GVHD.
Interpretation
Complications after ASCT for lymphoma have been significantly reduced since 2016.
Hovedfunn
Blant 120 pasienter som gjennomgikk allogen stamcelletransplantasjon for lymfom i tidsperiodene 2011–16 og 2016–21, falt andelen som døde av transplantasjonsrelaterte komplikasjoner – inkludert transplantat-mot-vert-sykdom – innen to år fra 28 % til 15 %.
Blant pasienter transplantert i perioden 2011–16, levde 22 % uten residiv eller transplantat-mot-vert-sykdom etter to år, mot 47 % av de som ble transplantert i 2016–21.
Allogen stamcelletransplantasjon er en potensielt kurativ behandling for pasienter med maligne blodsykdommer, lymfom og enkelte ikke-maligne tilstander. Den medfører imidlertid risiko for alvorlige komplikasjoner og transplantasjonsrelatert død grunnet organskader, infeksjoner og transplantat-mot-vert-sykdom. Behandlingen er aktuell for pasienter med lymfom som får tilbakefall eller ikke responderer på standardbehandling (1). For enkelte pasienter med spesielt alvorlige sykdomskarakteristika, kan behandlingen være aktuell allerede som ledd i førstelinjebehandlingen.
Lymfom er en samlediagnose for mer enn 30 ulike typer kreft som vanligvis oppstår i lymfoide organer. Symptomer kan være forstørrede lymfeknuter, feber og vekttap. Lymfomene inndeles i to hovedgrupper: Hodgkins lymfom og non-Hodgkins lymfom. Hodgkins lymfom oppstår ofte hos yngre og har vanligvis god prognose. Non-Hodgkins lymfom er den største gruppen og består av hovedgruppene B-cellelymfom og T-cellelymfom. Diffust storcellet B-cellelymfom er den vanligste typen og utgjør 30–40 % av tilfellene. Valg av behandling er avhengig av lymfomtype, utbredelse og grad av aggressivitet, og kan bestå av en kombinasjon av kjemoterapi, strålebehandling og immunterapi. Overlevelse for pasienter med lymfom har bedret seg betydelig over tid. Dette skyldes bedre diagnostikk, bedre støttebehandling, intensivert behandling av de mest aggressive lymfomene og nye medikamenter (2). Behandling med kimær antigenreseptor T-celleterapi (CAR-T) har gitt en del pasienter en ny mulighet for langtidsoverlevelse eller kurasjon, og har ført til en nedgang i allogene stamcelletransplantasjoner for pasienter med lymfom (3).
Allogen stamcelletransplantasjon er en form for immunterapi der pasienten får blodstamceller fra en familiedonor eller en ubeslektet donor, med mål om at T-lymfocytter fra donor skal utrydde eventuell gjenværende kreftsykdom og beskytte pasienten mot tilbakefall. Pasientens egne immunceller er i forkant svekket eller utslettet etter forbehandling (såkalt kondisjonering) med kjemoterapi alene eller i kombinasjon med strålebehandling. Før selve transplantasjonen kan gjennomføres, må sykdommen være bragt under god kontroll med induksjonsbehandling, som kan bestå av kjemoterapi, stråling eller immunterapi gitt i ulike kombinasjoner.
Avdeling for blodsykdommer ved Oslo universitetssykehus har landsfunksjon for allogen stamcelletransplantasjon ved lymfom hos voksne. I perioden 2011 til 2023 ble 154 slike pasienter transplantert, noe som utgjør 13 % av de transplanterte pasientene i denne perioden. Resultater fra transplantasjonsvirksomheten er tidligere publisert i Tidsskriftet (4, 5). Vo og medarbeidere sin studie inkluderer alle pasienter som ble transplantert i perioden 2015 til 2021, og dokumenterer bedring i ettårsoverlevelse og reduksjon av komplikasjoner i denne perioden (5).
Noen av pasientene i vår studie er inkludert i tidligere publikasjoner fra vårt senter. Det er imidlertid ulike utfordringer knyttet til de forskjellige diagnosegruppene som mottar allogen stamcelletransplantasjon. Transplantasjon ved lymfom har vært forbundet med høy forekomst av komplikasjoner (6). I denne studien ønsket vi spesielt å se på resultater for pasienter med lymfom.
Transplantat-mot-vert-sykdom er en alvorlig og potensielt dødelig komplikasjon, der T-lymfocytter fra donor angriper mottagerens friske vev og organer. Den inndeles i en akutt form, som vanligvis debuterer innen 100 dager, og en kronisk form, som vanligvis debuterer etter dette tidspunktet. Begge typer kan gi store helseplager og være dødelige. Organer som kan bli angrepet, er for eksempel huden, i form av utslett, øynene, i form av tørrhet og betennelse, og tarmene, med sårdannelser og diaré. Alle pasienter får immundempende behandling for å redusere risikoen. I oktober 2016 ble det i tillegg innført profylakse med antitymocyttglobulin for å redusere denne komplikasjonen. Antitymocyttglobulin er et antistoff som virker immundempende ved å redusere antallet T-lymfocytter som kan delta i immunresponsen. I riktig dosering reduserer medikamentet risikoen for transplantat-mot-vert-sykdom og død uten å føre til økt risiko for residiv (7). En studie fra vårt senter viser at transplantasjonsrelatert dødelighet ble redusert fra 33 % til 17 %. I tillegg økte sjansen for å overleve uten transplantat-mot-vert-sykdom eller residiv fra 43 % til 64 % etter tre år når antitymocyttglobulin ble gitt til pasienter med maligne blodsykdommer transplantert med stamceller høstet fra blod (8).
I denne studien har vi sammenlignet to pasientgrupper med lymfom som ble transplantert henholdsvis før og etter innføringen av profylakse med antitymocyttglobulin. Alle pasientene er fulgt i minst to år, og vi har valgt å presentere to års data.
Materiale og metode
Dette er en retrospektiv registerstudie og inkluderer pasienter som ble transplantert for lymfom for første gang ved Avdeling for blodsykdommer, Oslo universitetssykehus i perioden 1.1.2011 til 30.9.2021. Én pasient var < 18 år, de øvrige var ≥ 18 år. Spesifikasjon av de ulike lymfomtypene framgår av tabell 1. Pasienter som hadde lymfom i kombinasjon med andre kreftdiagnoser eller immunsvikt, ble ekskludert. Data ble hentet fra avdelingens kvalitetsregister, med kobling til Folkeregisteret.
Tabell 1
Lymfomtype, to års overlevelse og residivfri overlevelse for 120 pasienter behandlet med allogen stamcelletransplantasjon ved Oslo universitetssykehus i perioden 1.1.2011–30.9.2021.
| Type lymfom | Antall pasienter gruppe 1 + 2 | To års overlevelse i % | To års residivfri overlevelse i % | |
|---|---|---|---|---|
| Hodgkins lymfom | 10 | 70 (33–89) | 40 (12–67) | |
| B-cellelymfomer: | ||||
| Diffust storcellet B-cellelymfom | 22 | 55 (32–72) | 55 (32–72) | |
| Follikulært lymfom | 18 | 61 (35–79) | 56 (31–75) | |
| Mantelcellelymfom | 27 | 89 (69–96) | 74 (53–87) | |
| Transformert follikulært lymfom | 11 | 64 (30–85) | 64 (30–85) | |
| Andre/blandingslymfomer | 6 | - | - | |
| T-cellelymfomer: alle undergrupper | 26 | 58 (37–74) | 39 (20–56) | |
Pasientene ble delt i to grupper: Gruppe 1 (65 pasienter) ble transplantert i perioden 1.1.2011–30.9.2016; gruppe 2 (55 pasienter) i perioden 1.10.2016–30.9.2021. Datauthenting og sensurdato var 24.1.2024. Alle pasienter ble fulgt i minst to år eller fram til de døde før dette tidspunktet. Vi registrerte overlevelse, residivfri overlevelse og transplantasjonsrelatert død. Transplantasjonsrelatert død ble definert som alle dødsfall som ikke skyldtes residiv, og inkluderer død av transplantat-mot-vert-sykdom, multiorgansvikt, infeksjon, hjertesykdom, post-transplantasjonslymfom, hjerneinfarkt og blødning. Pasienter som levde ved siste kontroll uten å ha fått residiv, ble sensurert. Vi registrerte akutt og kronisk transplantat-mot-vert-sykdom. Akutt transplantat-mot-vert-sykdom graderes fra I–IV, der grad III og IV karakteriseres som alvorlig, det vil si med betydelig påvirkning på livskvalitet og med risiko for død. Vi registrerte kronisk transplantat-mot-vert-sykdom for pasienter som levde > 100 dager. Denne graderes som mild, moderat og alvorlig. Alle grader gir pasienten helseplager, og alvorlig grad kan føre til død. Overlevelse uten transplantat-mot-vert-sykdom eller residiv ble registrert: Hendelser ble definert som det som kom først av grad III–IV akutt transplantat-mot-vert-sykdom, moderat eller alvorlig kronisk transplantat-mot-vert-sykdom, residiv eller død. Pasienter hvor det ikke var registrert hendelse ved siste kontroll, ble sensurert.
Statistiske analyser
Kategoriske variabler er presentert som antall og prosentandeler, mens kontinuerlige variabler er presentert som medianverdi med laveste og høyeste observerte verdi. Kaplan-Meier-estimatoren er brukt til å beregne overlevelsessannsynlighet, residivfri overlevelse og overlevelse uten residiv eller transplantat-mot-vert-sykdom. Kumulativ insidens av behandlingsrelatert død, transplantat-mot-vert-sykdom og residiv ble estimert etter Fine-Gray-metoden (9). Analyser er utført med Statistica, versjon 14.0 (TIBCO, CA, USA) og EZR, versjon 1.61 (Saitama Medical Center, Japan).
Etikk
Registeret er godkjent av personvernombudet ved sykehuset og har tillatelse fra Regionale komiteer for medisinsk og helsefaglig forskningsetikk (REK) for publisering (referanse 11909/2021).
Resultater
Pasienter
Pasientkarakteristika er vist i tabell 2. Median oppfølgingstid var 101 måneder (30–145) i gruppe 1 og 57 måneder (28–83) i gruppe 2. Median alder ved transplantasjonstidspunktet var henholdsvis 57 (16–66) og 61 år (31–72). I hele gruppen var de hyppigst forekommende B-cellelymfomene mantelcellelymfom (27 pasienter) og diffust storcellet B-cellelymfom (22 pasienter). 26 pasienter hadde T-cellelymfom og 10 pasienter hadde Hodgkins lymfom (tabell 1).
Tabell 2
Pasient- og donorkarakteristika, stamcellekilder, profylakse mot transplantat-mot-vert-sykdom og forbehandling for 120 pasienter med lymfom som ble behandlet med allogen stamcelletransplantasjon ved Oslo universitetssykehus i perioden 1.1.2011–30.9.2016 (gruppe 1) og i perioden 1.10.2016–30.9.2021 (gruppe 2).
| Variabel | Gruppe 1 | Gruppe 2 | |
|---|---|---|---|
| Antall pasienter | 65 | 55 | |
| Alder ved transplantasjon, år, median (spredning) | 57 (16–66) | 61 (31–72) | |
| Kjønn | |||
| Menn (antall) | 47 | 39 | |
| Kvinner (antall) | 18 | 16 | |
| Donors alder, år, median (spredning) | 41 (19–72) | 26 (18–70) | |
| Donortype, antall | |||
| Vevsidentisk familiegiver | 23 | 6 | |
| Ubeslektet giver | 40 | 48 | |
| HLA-haploidentisk giver1 | 2 | 1 | |
| Stamcellekilde antall | |||
| Benmarg | 3 | 1 | |
| Blod | 62 | 54 | |
| Profylakse mot transplantat-mot-vert-sykdom, antall | |||
| Antitymocyttglobulin | 0 | 48 | |
| Ciklosporin og sirolimus | 54 | 43 | |
| Andre medikamenter | 11 | 12 | |
| Forbehandling før transplantasjonen, antall | |||
| Benmargsutryddende | 2 | 1 | |
| Redusert intensitet | 63 | 54 | |
1Familiegiver som deler én haplotype (en samling med gener som nedarves fra en av foreldrene) med pasienten.
Transplantasjonsforløpet
Karakteristika for donor, stamcellekilder, forbehandling og profylakse mot transplantat-mot-vert-sykdom er oppgitt i tabell 2. 117/120 pasienter fikk intensitetsredusert forbehandling umiddelbart før transplantasjonen, 3 fikk kraftigere, benmargsutryddende forbehandling. 48/55 pasienter i gruppe 2 fikk antitymocyttglobulin i tillegg til annen immunsuppresjon.
Overlevelse, dødsårsaker og residiv
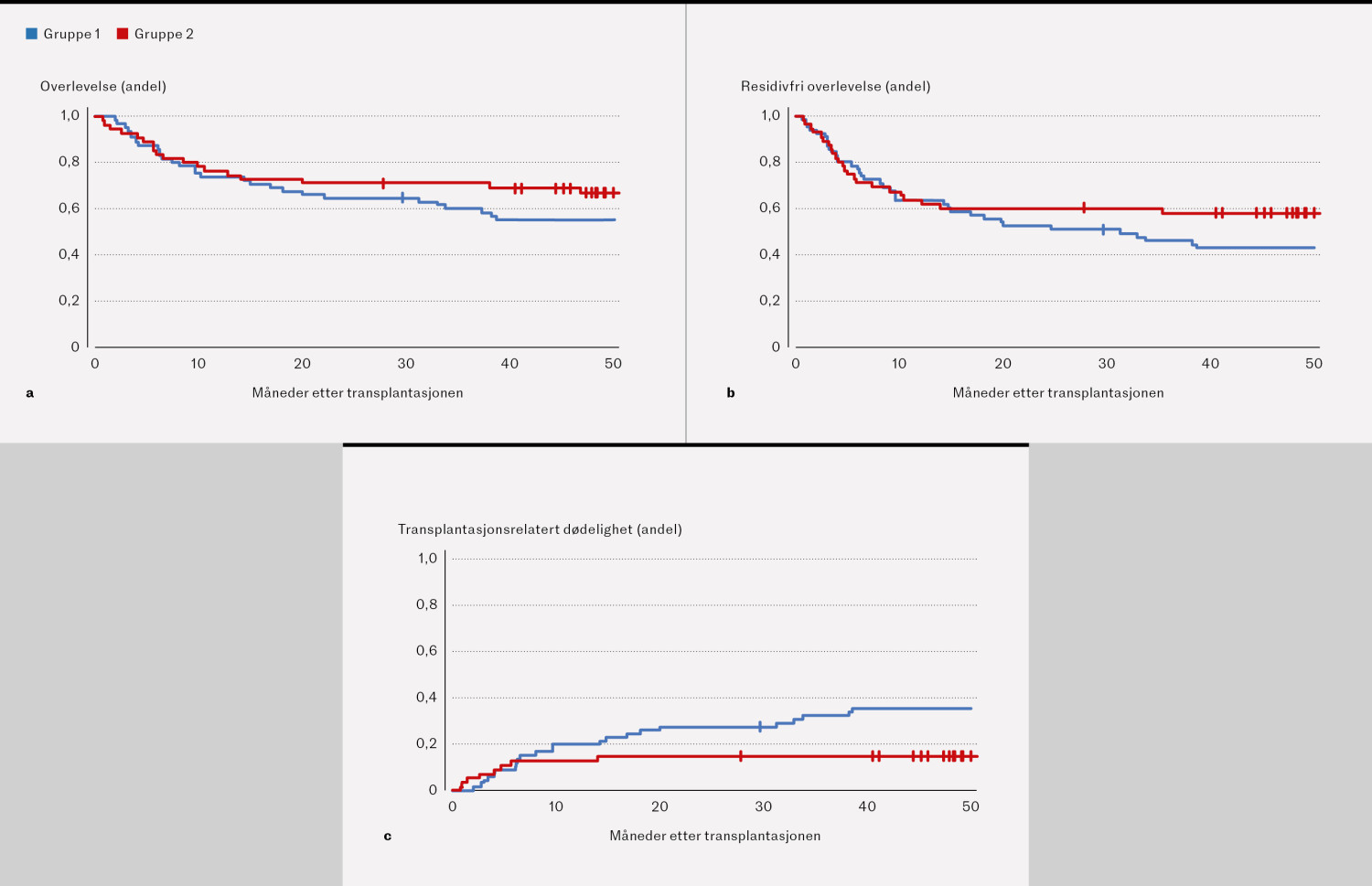
To års overlevelse var 42/65 (65 %) i gruppe 1 og 39/55 (71 %) i gruppe 2 (figur 1a). Residivfri to års overlevelse var henholdsvis 34/65 (52 %) og 33/55 (60 %) (figur 1b). Transplantasjonsrelatert dødelighet var 18/65 (28 %) i gruppe 1 og 8/55 (15 %) i gruppe 2 (figur 1c). 5/65 i gruppe 1 og 7/55 i gruppe 2 døde av residiv. De hyppigste dødsårsakene i gruppe 1 var transplantat-mot-vert-sykdom, multiorgansvikt og residiv, med 5 døde pasienter i hver av disse kategoriene. 8/23 pasienter døde av andre transplantasjonsrelaterte årsaker. I gruppe 2 døde 7/16 av residiv mens 8 pasienter døde av ulike transplantasjonsrelaterte årsaker. I ett tilfelle var dødsårsaken ukjent. Overlevelse og residivfri overlevelse for de ulike lymfomtypene er angitt i tabell 1.
Transplantat-mot-vert-sykdom
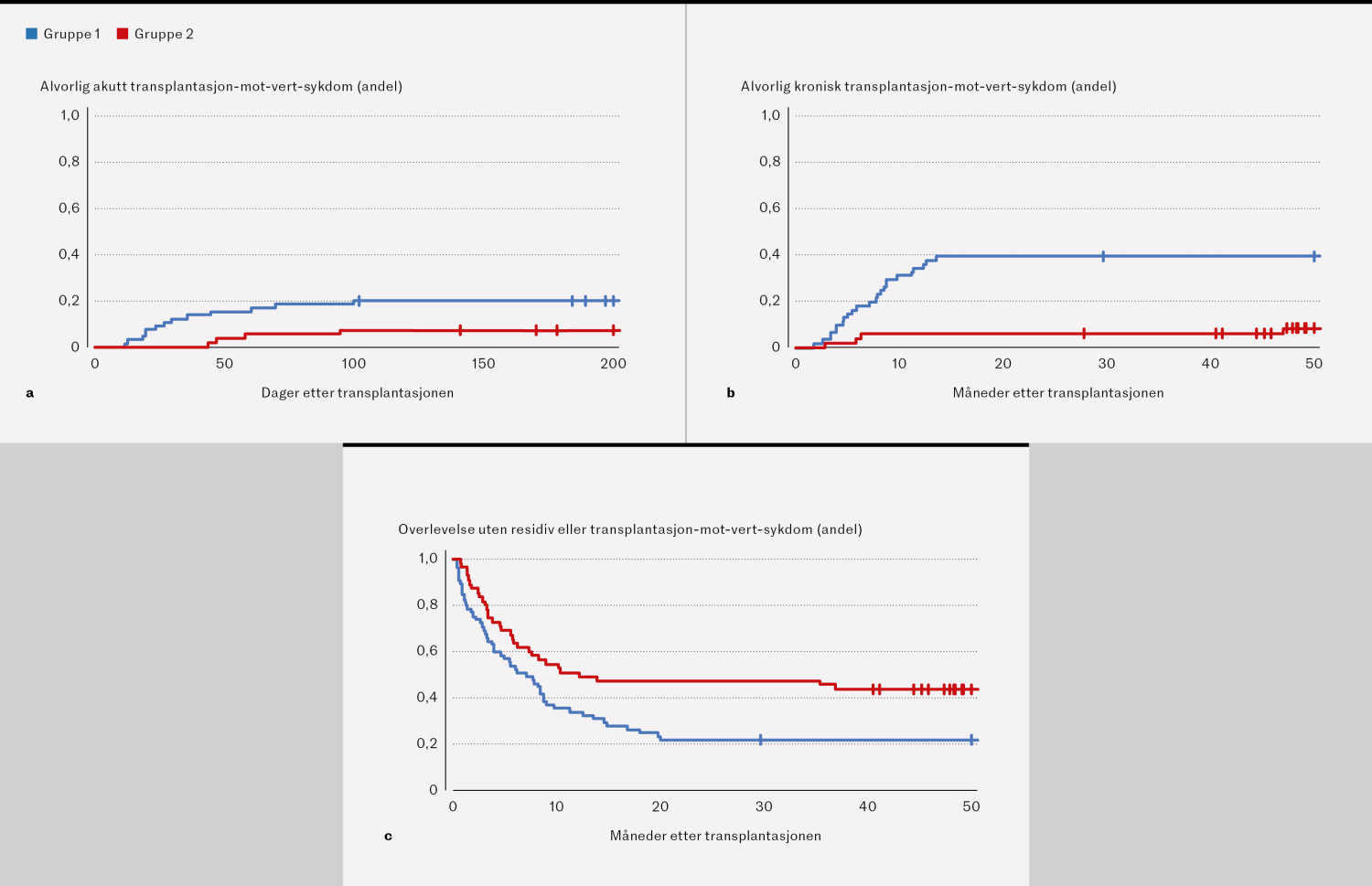
Etter to år hadde 13/65 pasienter (20 %) i gruppe 1 og 4/55 pasienter (7 %) i gruppe 2 utviklet alvorlig akutt transplantat-mot-vert-sykdom (figur 2a). Av pasientene som levde i minst 100 dager, hadde 24/61 pasienter i gruppe 1 (39 %) og 3/51 pasienter i gruppe 2 (6 %) utviklet alvorlig kronisk transplantat-mot-vert-sykdom etter to år (figur 2b). Antallet pasienter med to års overlevelse uten residiv eller transplantat-mot-vert-sykdom, var 14/65 (22 %) i gruppe 1 og 26/55 (47 %) i gruppe 2 (figur 2c)
Diskusjon
I vår studie av 120 pasienter som ble transplantert for ulike typer lymfomer i perioden 2011–21, fant vi en betydelig reduksjon av transplantasjonsrelatert dødelighet og forekomst av transplantat-mot-vert-sykdom etter to år for pasienter transplantert i perioden 2016–21, sammenliknet med 2011–16. Andelen som fikk alvorlig akutt transplantat-mot-vert-sykdom, falt fra 20 % til 7 %, og andelen som fikk alvorlig kronisk transplantat-mot-vert-sykdom, falt fra 39 % til 6 % i de to tidsrommene. Reduksjonen i komplikasjoner og transplantasjonsrelatert dødelighet etter allogen stamcelletransplantasjon over tid er i tråd med våre egne og andres erfaringer (5, 10–13).
Overlevelse uten residiv eller transplantat-mot-vert-sykdom er det ønskede behandlingsresultatet etter allogen stamcelletransplantasjon. Dette regnes for å være et godt surrogatmål for en vellykket behandling, og betyr at pasienten lever uten residiv og uten transplantat-mot-vert-sykdom som går ut over livskvaliteten. I gruppe 1 var det 22 % som oppnådde dette, mens det i gruppe 2 var 47 %, noe som er en klinisk betydningsfull bedring.
Den største forskjellen i behandlingsopplegget i de to tidsperiodene er at flertallet av pasientene i den siste gruppen fikk profylakse med antitymocyttglobulin i tillegg til standard immunsuppresjon. Dette bidro til en betydelig nedgang i andelen pasienter som fikk alvorlig transplantat-mot-vert-sykdom og som døde av denne komplikasjonen. Det er imidlertid gjort endringer i transplantasjonsprogrammet i hele perioden 2011–21, noe som sannsynligvis også har bidratt til å bedre resultatene: Hvert transplantasjonsforløp blir skreddersydd til den enkelte pasient. Stamcelledonorens vevstype blir nøye tilpasset pasientens, og det er økende bruk av unge, ubeslektede donorer framfor eldre familiedonorer. Forbehandlingen før selve transplantasjonen tilpasses den enkelte pasient, både med tanke på ønsket effekt på kreftsykdommen og pasientens forventede toleranse.
Total dødelighet synes ikke å være lavere i gruppen som ble transplantert i 2016–21, sammenlignet med i 2011–16, men det er en trend mot lavere dødelighet i den siste gruppen, som vi mener kunne blitt signifikant med et større materiale og/eller lengre observasjonstid. I den siste gruppen døde noen flere pasienter av residiv, men tallene er for små til å trekke noen konklusjoner. Det er lavere risiko for alvorlige komplikasjoner og transplantasjonsrelatert død i denne gruppen, og en større andel av pasientene lever med bedre livskvalitet enn tidligere, før enkelte får residiv. Residiv er fremdeles en stor utfordring ved allogen stamcelletransplantasjon ved maligne sykdommer, og prognosen etter residiv er som oftest dårlig.
Når man sammenligner resultatene for de forskjellige typene lymfomer for hele perioden sett under ett, er resultatene best for pasienter med mantelcellelymfom, der 89 % var i live, og 74 % levde uten residiv etter to år (tabell 1). Ved mantelcellelymfom forventes de fleste residivene å komme innen to år, men senere residiver kan også forekomme (14). Pasienter med T-cellelymfom gjør det dårligst: 58 % levde etter to år, og 39 % var uten residiv. Resultatene er omtrent på linje med det andre har funnet (15). Det er få pasienter i hver diagnosegruppe, og resultatene har vide konfidensintervaller. Vi vurderer det imidlertid slik at tallene stemmer godt med klinisk erfaring, og gir et relativt godt bilde av resultatet etter allogen stamcelletransplantasjon for ulike typer lymfomer.
For at transplantasjon skal gjennomføres, er det krav om at sykdommen er bragt under god kontroll. Vi har ikke detaljert informasjon om sykdomsstatus på transplantasjonstidspunktet for hver pasient, men for de mest aggressive lymfomene, som for eksempel diffust storcellet B-cellelymfom, er det et generelt krav om at sykdommen er i komplett remisjon, det vil si at pasienten er sykdomsfri. For de mindre aggressive, såkalt indolente lymfomene, som follikulære lymfomer, kreves det minst delvis respons, såkalt partiell remisjon. Vi kan ikke trekke noen sikre konklusjoner om hva remisjonsstatus har hatt å si for resultatet for våre pasienter, men det har vært ført en restriktiv linje med krav om god sykdomskontroll, noe vi mener har bidratt til gode behandlingsresultater.
Alle allogene stamcelletransplantasjoner for pasienter med lymfom gjennomføres ved Oslo universitetssykehus, og resultatene oppfattes som representative for pasienter som gjennomgår slik behandling. Disse pasientene utgjør imidlertid en selektert gruppe der man har oppnådd god sykdomskontroll, og der pasienten for øvrig anses å kunne tåle en slik krevende behandling.
Data plottes fortløpende inn i vårt register av dedikert personell, og registreringen av komplikasjoner og dødsfall vurderes å ha vært konsistent i hele tidsperioden.
Konklusjon
De siste årene har det kommet flere nye behandlingsmuligheter for pasienter med lymfom. Riktig bruk av allogen stamcelletransplantasjon forutsetter kunnskap om komplikasjoner og forventet effekt av slik behandling. Studien viser at risikoen for alvorlige transplantasjonsrelaterte komplikasjoner var betydelig lavere for pasienter som ble transplantert i 2016–21 sammenlignet med 2011–16. Residiv etter transplantasjonen er imidlertid en utfordring. Behandlingen framstår som et godt alternativ for utvalgte pasienter.
Artikkelen er fagfellevurdert.
Lymfekreft handlingsprogram: https://www.helsedirektoratet.no/retningslinjer/lymfekreft-handlingsprogram Lest 15.8.2024.
Kreftregisteret. Nasjonalt kvalitetsregister for lymfoide maligniteter. Resultater og forbedringstiltak fra Nasjonalt kvalitetsregister for lymfoide maligniteter. Årsrapport 2023. https://www.kreftregisteret.no/globalassets/publikasjoner-og-rapporter/arsrapporter/publisert-2024/arsrapport-2023-nasjonalt-kvalitetsregister-for-lymfoide-maligniteter.pdf Lest 15.1.2025
Passweg JR, Baldomero H, Ciceri F et al. Hematopoietic cell transplantation and cellular therapies in Europe 2022. CAR-T activity continues to grow; transplant activity has slowed: a report from the EBMT. Bone Marrow Transplant 2024; 59: 803–12. [PubMed][CrossRef]
Husøy MAR, Brinch L, Tjønnfjord GE et al. Allogen stamcelletransplantasjon hos voksne 1985-2012. Tidsskr Nor Legeforen 2014; 134: 1569–75. [PubMed][CrossRef]
Vo CD, Myhre AE, Abrahamsen IW et al. Allogen stamcelletransplantasjon hos voksne 2015–21. Tidsskr Nor Legeforen 2023; 143. doi: 10.4045/tidsskr.22.0521. [PubMed][CrossRef]
Fløisand Y, Brinch L, Gedde-Dahl T et al. Ultra-short course sirolimus contributes to effective GVHD prophylaxis after reduced-intensity allogeneic hematopoietic cell transplantation. Bone Marrow Transplant 2012; 47: 1552–7. [PubMed][CrossRef]
Walker I, Panzarella T, Couban S et al. Addition of anti-thymocyte globulin to standard graft-versus-host disease prophylaxis versus standard treatment alone in patients with haematological malignancies undergoing transplantation from unrelated donors: final analysis of a randomised, open-label, multicentre, phase 3 trial. Lancet Haematol 2020; 7: e100–11. [PubMed][CrossRef]
Ali MM, Grønvold B, Remberger M et al. Addition of Anti-thymocyte Globulin in Allogeneic Stem Cell Transplantation With Peripheral Stem Cells From Matched Unrelated Donors Improves Graft-Versus-Host Disease and Relapse Free Survival. Clin Lymphoma Myeloma Leuk 2021; 21: 598–605. [PubMed][CrossRef]
Fine JP, Gray RJ. A Proportional Hazards Model for the Subdistribution of a Competing Risk. J Am Stat Assoc 1999; 94: 496–509. [CrossRef]
McDonald GB, Sandmaier BM, Mielcarek M et al. Survival, Nonrelapse Mortality, and Relapse-Related Mortality After Allogeneic Hematopoietic Cell Transplantation: Comparing 2003-2007 Versus 2013-2017 Cohorts. Ann Intern Med 2020; 172: 229–39. [PubMed][CrossRef]
Remberger M, Ackefors M, Berglund S et al. Improved survival after allogeneic hematopoietic stem cell transplantation in recent years. A single-center study. Biol Blood Marrow Transplant 2011; 17: 1688–97. [PubMed][CrossRef]
Penack O, Peczynski C, Mohty M et al. How much has allogeneic stem cell transplant-related mortality improved since the 1980s? A retrospective analysis from the EBMT. Blood Adv 2020; 4: 6283–90. [PubMed][CrossRef]
Cooper JP, Storer BE, Granot N et al. Allogeneic hematopoietic cell transplantation with non-myeloablative conditioning for patients with hematologic malignancies: Improved outcomes over two decades. Haematologica 2021; 106: 1599–607. [PubMed][CrossRef]
Lew TE, Cliff ERS, Dickinson M et al. Allogeneic stem cell transplantation achieves long-term remissions in mantle cell lymphoma, including in TP53-mutated disease. Leuk Lymphoma 2023; 64: 1792–800. [PubMed][CrossRef]
Singh V, Kim S, Deol A et al. Allogeneic hematopoietic stem cell transplantation in T-cell lymphoma: a Meta-Analysis. Leuk Lymphoma 2022; 63: 855–64. [PubMed][CrossRef]