En mann i 60-årene ble innlagt akutt grunnet dyspné, brystsmerter og synkope. Medisinsk team konstaterte raskt at han befant seg i en sjokktilstand. Tverrfaglig håndtering førte til vellykket diagnostisering og behandling av en tilstand med høy dødelighet.
En mann i 60-årene med inflammatorisk tarmsykdom og prednisolonbehandlet myopati ringte ambulanse på nattestid grunnet akutt forverring av åndenød. Han hadde vært tung i pusten 3–4 uker i forkant, men ble betydelig mer besværet den aktuelle natten. Før han tilkalte hjelp, hadde han besvimt to ganger. Da ambulansen kom til stedet, angav han smerter i hele kroppen, inkludert sterke sentrale brystsmerter.
Pasienten hadde sentral cyanose, med SpO2 70 % uten oksygen, stigende til 93 % med 12 liter oksygen på maske med reservoar. Blodtrykket var 115/70 mmHg, pulsen vekslet mellom 130 slag/min og 145 slag/min.
Under transport sendte ambulansen EKG til hjerteavdelingen for prehospital vurdering (figur 1). EKG viste sinustakykardi frekvens 143 slag/min, økt amplitude av P-bølgen i avledning II og III forenlig med p-pulmonale, subtil ST-elevasjon i avledning V1 og aVR samt ST-depresjon i V4–V6, II, III og aVF.
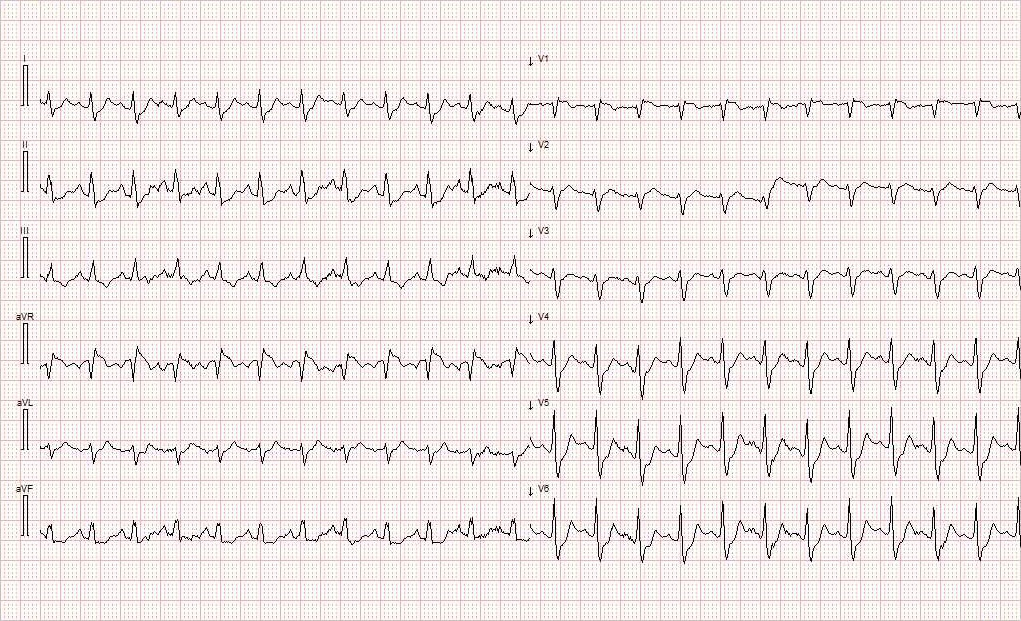
Differensialdiagnostiske overveielser var akutt koronarsyndrom med utbredt iskemi, grunnet funn av ST-depresjoner i multiple avledninger og ST-elevasjon i V1 og aVR. Gjennomgått infarkt med påfølgende utvikling av akutt hjertesvikt med lungeødem ble også vurdert. I tillegg vurderte man lungeembolisme grunnet funn av sinustakykardi og p-pulmonale, som tydet på dilatasjon av høyre atrium.
Ambulansepersonell sendte 25 minutter senere inn et nytt EKG (figur 2), som viste atrieflimmer med frekvens 120 slag/min, breddeøkt QRS-kompleks med høyre grenblokk-mønster samt T-inversjon i III og V1–V3.
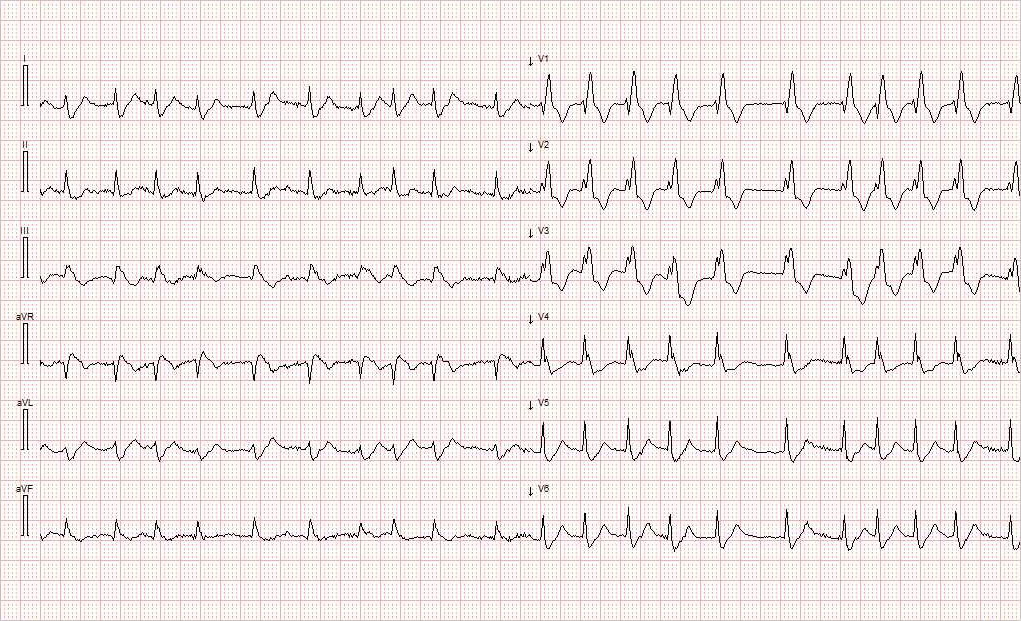
Både nyoppstått atrieflimmer med lavere frekvens enn i sinusrytme og høyre grenblokk er tegn på sviktende ledningssystem. I tillegg er T-inversjonene typiske funn ved dilatasjon av høyre ventrikkel.
Pasienten ble tatt imot av et medisinsk team kort tid etter at siste EKG ble mottatt. Han var våken og svarte adekvat på spørsmål. Ved primærundersøkelsen hadde han frie luftveier. Oksygensaturasjonen var 100 % med 12 liter O2 og respirasjonsfrekvensen 17 i minuttet. Ved auskultasjon ble det hørt klare lungelyder. Han var kald og klam i huden uten perifere pulser, men med palpable lyskepulser bilateralt. Blodtrykk ble målt til 50/30 mmHg med arteriekran. På skop ble det sett sinustakykardi med frekvens 120 slag/min og QRS-konfigurasjon som ved høyre grenblokk. Pasienten var afebril med temperatur 37,0 °C. Arteriell blodgass tatt med tilførsel av 12 liter oksygen viste pH 7,36 (referanseområde 7,35–7,45), pCO2 4,45 kPa (4,7–5,9), pO2 13,8 kPa (11,1–14,4) og laktat 4,6 mmol/L (0–2,5).
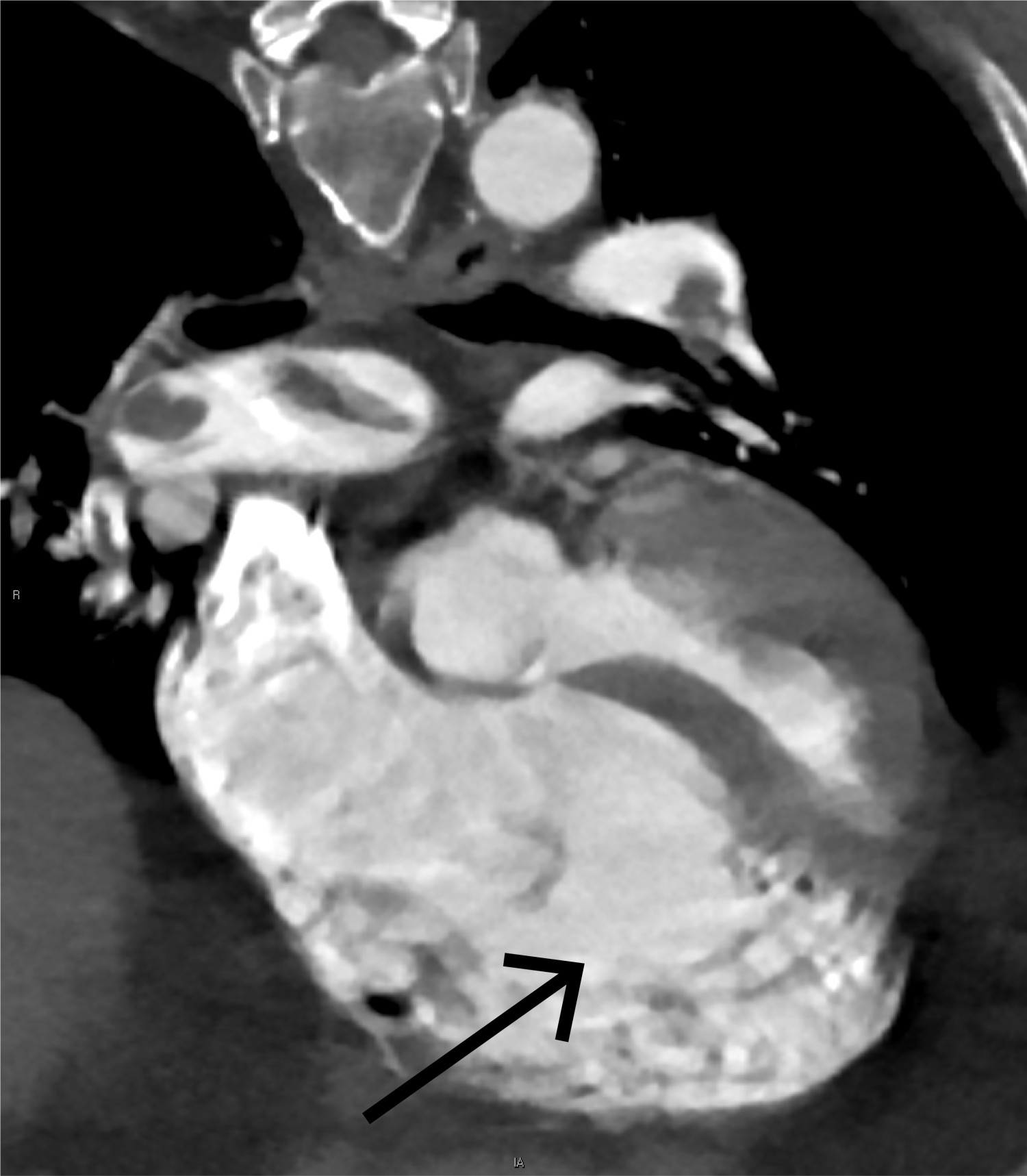
Orienterende ekkokardiografi viste betydelig dilatasjon av høyre ventrikkel, der høyre ventrikkel (RV) hadde klart større diameter enn venstre (LV), med en RV/LV-ratio 1,3. Normalt ratio er 0,66, og alt over 1,0 er klart patologisk (1). Høyre ventrikkel fremstod med redusert langaksefunksjon, TAPSE (tricupid annular plane excursion) målt til 10 mm (normalt > 17). I høyre atrium ble det observert en stor flagrende masse, som ga mistanke om trombe (figur 3, video). Venstre ventrikkel hadde svekkede kontraksjoner i septum og var komprimert fra den dilaterte høyre hjertehalvdelen. Dopplervurderinger var forenlig med underfylling av venstre ventrikkel. Aorta ascendens var normaldimensjonert, men det ble sett en aortainsuffisiens som var vanskelig å gradere i akuttsituasjonen.
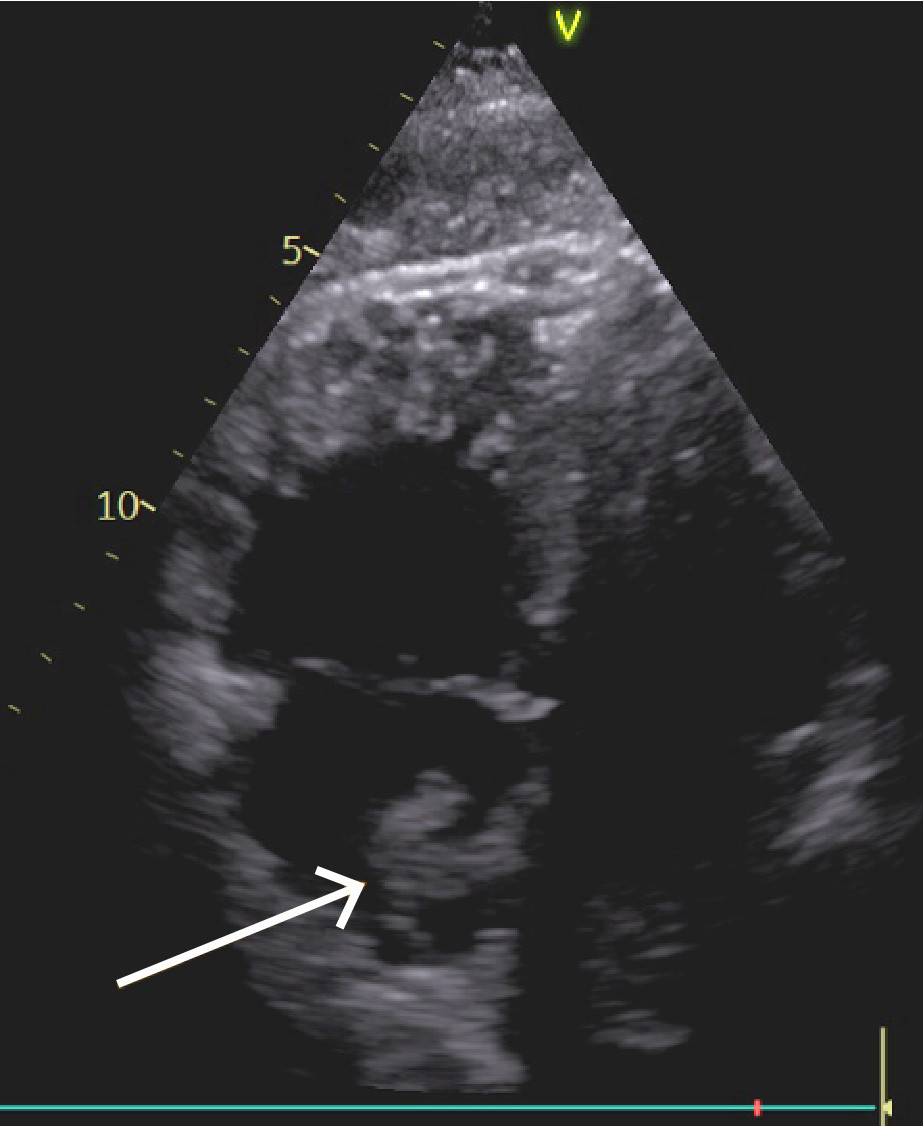
Akutt sentral lungeembolisme med påfølgende høyresidig hjertesvikt, redusert hjerteminuttvolum og sirkulasjonssvikt fremsto som den mest sannsynlige årsaken til det aktuelle. Funn av aortainsuffisiens gjorde at man etter ekkokardiografivurderingen ikke med sikkerhet kunne utelukke samtidig aortadisseksjon. Det var derfor ønskelig å gjennomføre CT-undersøkelse før administrering av trombolytisk behandling med alteplase.
Etter diskusjon i teamet ble det i henhold til lokale og internasjonale retningslinjer gitt 5 000 IE heparin intravenøst ti minutter etter at pasienten ankom akuttmottaket (2). For å øke blodtrykket ble det gitt 0,01 mg adrenalin intravenøst og startet noradrenalininfusjon med infusjonshastighet 0,3 µg/kg/min. Samtidig ble intervensjonsradiolog og radiograf tilkalt.
Pasienten var våken og klar, respiratorisk stabil, men vedvarende hemodynamisk ustabil etter administrering av heparin og oppstart av vasopressor. Pasienten ble transportert til røntgenavdelingen tilkoblet defibrillator og med alteplase klargjort for intravenøs administrasjon.
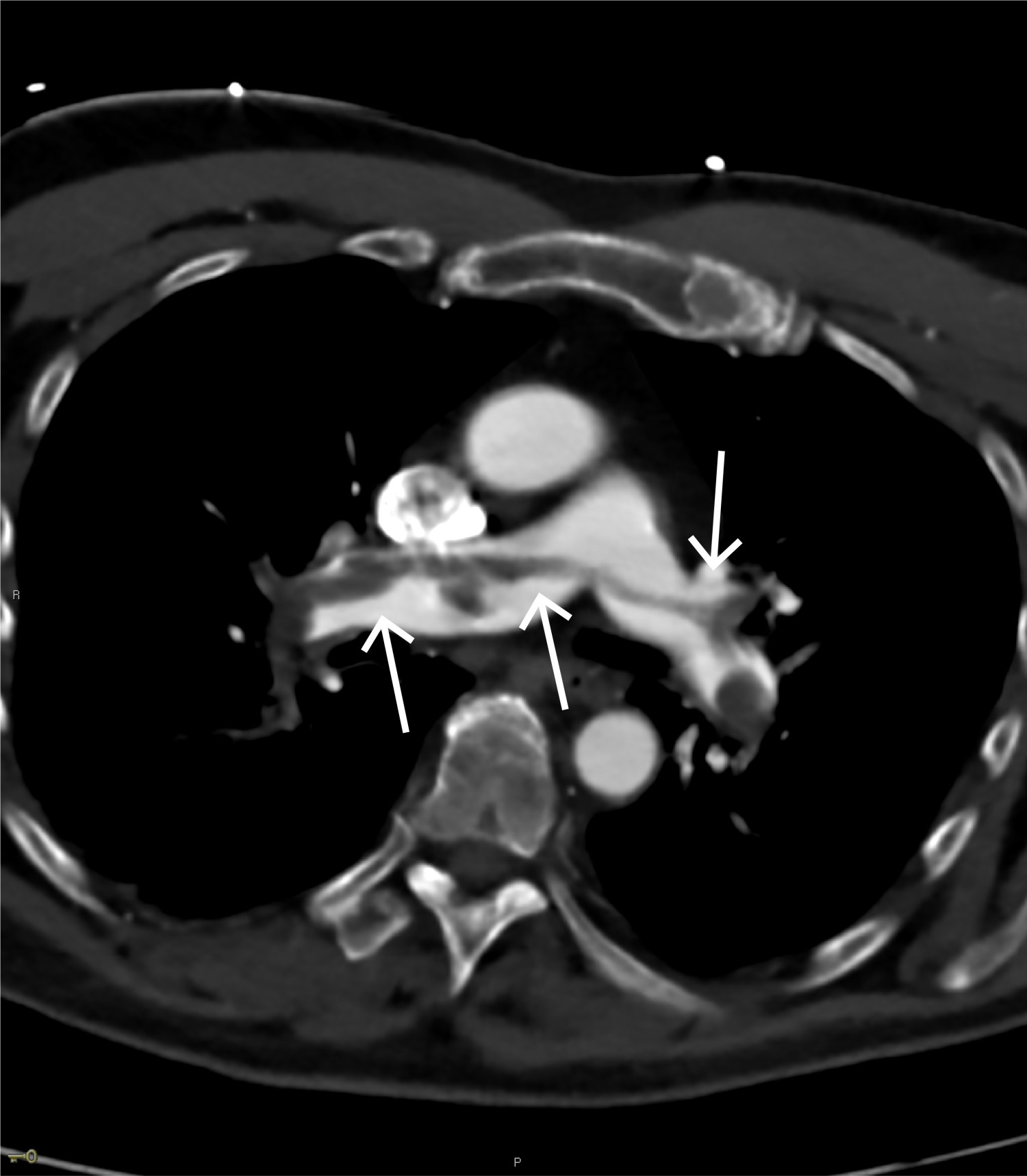
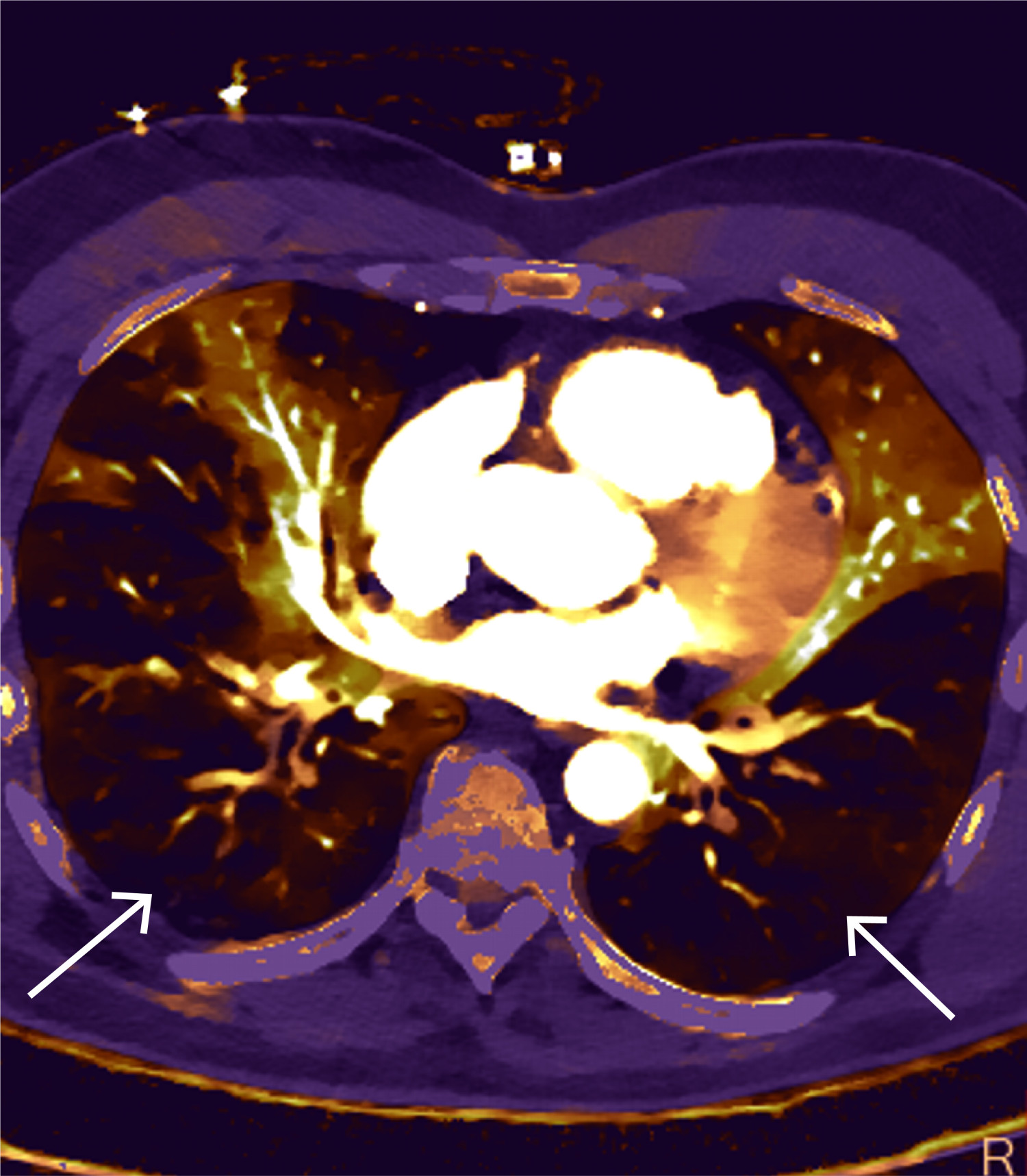
CT toraks med lungeemboliprotokoll viste sadelemboli, med tromber ut i de fleste større lungearterier og med affeksjon av alle lungelapper på lobært og segmentalt nivå (figur 4 og 5). Størst utfall var i underlapper. Aortadisseksjon ble ikke påvist.
Bolusdose med 10 mg intravenøs alteplase ble gitt umiddelbart etter at lungeembolidiagnosen ble verifisert og aortadisseksjon var utelukket, anslagsvis 40 minutter etter at pasienten ankom sykehuset. Deretter ble vedlikeholdsdose med alteplase på 90 mg påbegynt.
Intervensjonsradiolog og intervensjonsradiograf har døgnberedskap med 30 minutters utrykningstid. Da pasienten ankom CT-laboratoriet, var intervensjonsteamet allerede på plass, slik at bildene ble gransket umiddelbart, samtidig som pasienten ble transportert til hjerteovervåkningen for videre stabilisering og vurdering av behandlingseffekt.
På hjerteovervåkningen hadde pasienten vedvarende dyspné, sterke brystsmerter og middelarterietrykk (MAP) rundt 45 mmHg på tross av infusjon med alteplase, opptrappet noradrenalin til 0,40 µg/kg/min og påbegynt vasopressin med infusjonshastighet 0,03 IE/min. På grunn av den hemodynamisk ustabile situasjonen ble det gitt gjentatte doser fortynnet adrenalin for å forhindre ytterligere dekompensering.
Grunnet manglende effekt av systemisk alteplase og betydelig påvirket høyre ventrikkel ble man i teamet enige om å ta pasienten direkte til operasjonsstuen for akutt kateterbasert trombektomi. Pasienten ble ikke vurdert som hemodynamisk stabil nok for transport til sykehus med torakskirurgisk beredskap og tilgang på ekstrakorporal membranoksygenering (ECMO). Det hadde til sammen gått 1 time og 30 minutter fra pasienten ankom akuttmottaket til han var på operasjonsstuen.
I lokalbedøvelse ble det gjort ultralydveiledet punksjon av vena femoralis communis, og et vinklet grisehalekateter ble ført via vena cava inferior gjennom høyre hjertehalvdel til arteria pulmonalis (figur 6). Middeltrykket i truncus pulmonalis ved prosedyrestart ble målt til 37–39 mmHg (< 20 mmHg). Trombektomiutstyret som ble brukt, var FlowTriever (Inari Medical). Via 24 Fr og 16 Fr katetre ble det aspirert trombemasser fra begge lungers karsenger (figur 7). Totalt ti aspirasjoner ble utført.
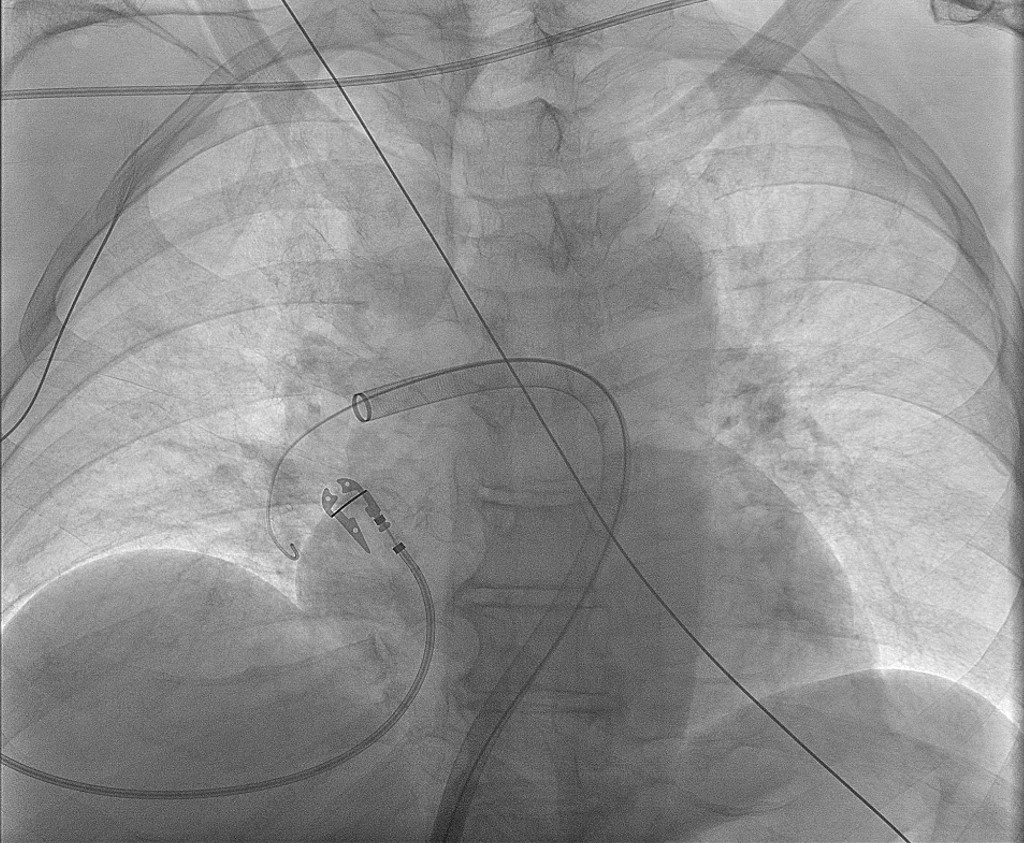
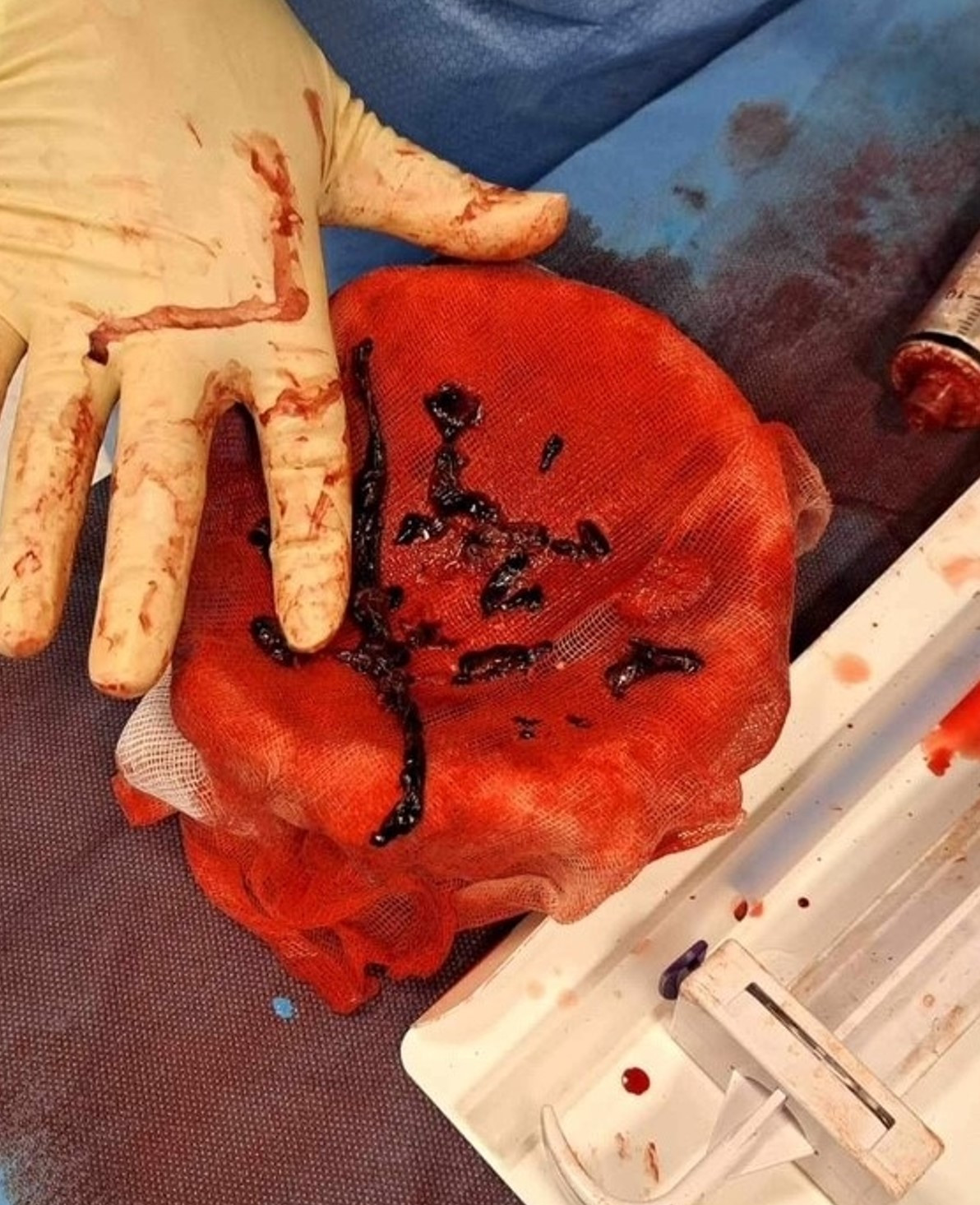
Det ble anslått et blodtap på til sammen 50–80 ml. Pasientens systemiske trykk steg umiddelbart etter trombeaspirasjonene, og man kunne trappe ned pressorbehandlingen. Vasopressin ble seponert og noradrenalininfusjonen redusert til 0,02 µg/kg/min. Objektivt og subjektivt observert dyspné bedret seg raskt. Ved avslutning av prosedyren ble middeltrykket i truncus pulmonalis målt til 19–20 mmHg. Angiografi viste akseptabel og rask fylling i de største segmentene i lungene på begge sider.
Etter prosedyren ble pasienten flyttet tilbake til hjerteovervåkningen. Det ble startet med heparininfusjon 1 320 IE/time som videre antikoagulerende behandling. Infusjonshastigheten ble styrt etter aktivert partiell tromboplastintid (APTT) (referanseområde 1,5 × utgangsverdien). Klinisk var pasienten ved dette tidspunktet uten smerter, og objektivt og subjektivt fri for dyspné. SpO2 var 97 % med 1 liter oksygen på nesegrime. Han var tørr og varm i huden. Blodtrykket var stigende til 111/62 mmHg med nedtrappende mengder vasopressor.
Svaret på laboratorieprøvene tatt ved innkomst var klar etter intervensjonen. De viste forhøyet troponin T til 284 ng/l (0–15) og NT-proBNP 1 571 ng/L (< 210).
Påfølgende dag var pasienten i bedring, og pressorbehandlingen kunne avsluttes. Man gikk over til dalteparin subkutant (100 E/kg × 2) som antikoagulerende behandling, da det ble ansett som lite sannsynlig med nytt behov for trombolyse med alteplase.
Ekkokardiografikontroll dagen etter innleggelsen viste normalisert hjertefunksjon og at begge ventriklene hadde normale kammerdimensjoner. Systolisk trykk i pulmonalarterien ble beregnet til 31 mmHg, som anses som normalt. Pasienten ble overflyttet til hematologisk sengepost og utskrevet etter totalt fem dager på sykehus. Han skulle fortsette med peroral antikoagulantia i form av rivaroksaban 20 mg × 1 per dag de første seks månedene og deretter 10 mg × 1 på ubestemt tid.
Diskusjon
Høyre ventrikkel-svikt er en fryktet komplikasjon ved massiv lungeembolisme og ses akutt i varierende alvorlighetsgrad hos 45 % av lungembolipasientene (3). Mekanismene i utviklingen av høyre ventrikkel-svikt i denne situasjonen er sammensatt. Sentrale lungeemboluser som okkluderer store deler av lungekarsengen, fører til at høyre ventrikkel må pumpe mot høy pulmonal vaskulær motstand (økt høyre ventrikkel-afterload). Høyre ventrikkel er tynnvegget og ikke konstruert for å tåle akutt afterloadøkning. Når dette skjer, oppstår redusert høyre ventrikkel-funksjon og kompensatorisk dilatasjon (figur 8). Sekundært til dette overskyves ventrikkelseptum mot venstre ventrikkel og gir redusert diastolisk fylning. Dette medfører redusert hjerteminuttvolum og koronar hypoperfusjon, med sekundær iskemi og ytterligere biventrikulær svikt. Iskemien forsterkes av hypoksemi og det faktum at høyre ventrikkel har økt oksygenbehov. Dilatasjonen av høyre ventrikkel gir samtidig strekk på trikuspidalringen, med sekundær trikuspidalinsuffisiens som også bidrar til redusert venstre ventrikkel-fylning. Det hele kan føre til sirkulatorisk dekompensasjon i form av obstruktivt sjokk, og i verste fall hjertestans (2, 3).
Lungeembolipasienter risikostratifiseres i akuttsituasjonen inn i en av fire grupper basert på risiko for mortalitet på kort sikt. De ulike gruppene er henholdsvis høyrisiko, intermediær høyrisiko, intermediær lavrisiko og lavrisiko. Inndelingen gjøres på bakgrunn av forekomst av hemodynamisk ustabilitet, hjertets høyre ventrikkel-funksjon, troponinverdier og skåren på Pulmonary Embolism Severity Index (PESI) (3). Korttidsoverlevelsen ved lungeembolisme som tilstand er svært varierende, med 30 dagers mortalitet fra 0 % i lavrisikogruppen til 24,5 % i høyrisikogruppen (2).
Akuttbehandling av lungeembolisme velges ut fra risikostratifiseringen og spenner fra behandling med direktevirkende antikoagulantia (DOAK) til systemisk trombolyse, endovaskulær eller kirurgisk trombektomi, avlastning med ekstrakorporal membranoksygenering (ECMO-behandling) og hjerte-lunge-redning (2). De endovaskulære behandlingsalternativene er relativt nye, da utstyret kun har vært på markedet i kort tid. I de fleste retningslinjer, inkludert de europeiske kardiologiske retningslinjene om lungeembolisme fra 2019 (2), anbefales således fortsatt primært systemisk trombolyse til høyrisikopasienter og hovedsakelig lavmolekylært heparin til pasienter med intermediær høyrisiko. For sistnevnte pasientgruppe gis det på vårt sykehus rom for å vurdere systemisk trombolyse der høyre ventrikkel er betydelig påvirket og det foreligger kompensatorisk takykardi.
I de samme europeiske retningslinjene angis det at perkutan kateterbasert behandling, herunder kateterbasert trombolyse eller trombektomi, kan vurderes hos høyrisikopasienter der trombolyse har feilet eller er kontraindisert (2). På vårt sykehus er det siden oppstart i 2023 utført henholdsvis ti kateterbaserte trombolyser og ti endovaskulære trombektomier. Anbefalingene for endovaskulære tilnærminger er begrenset av flere årsaker. Hovedsakelig er dette grunnet manglende sikkerhetsdata og sammenliknende studier med medikamentell behandling, i tillegg til at behandlingstilbudet er betydelig senter- og operatøravhengig. Etter hvert som utstyret blir mer tilgjengelig og utprøvd, vil det etter all sannsynlighet komme mer data på området og potensielt endrede anbefalinger (4). Til nå har man blant annet i en multisenter, prospektiv registerstudie – FLASH – sett på 1 000 pasienter med høy- og intermediær risiko for lungeembolisme som ble behandlet med endovaskulær trombektomi. Resultatene er lovende og viser betydelig bedring i høyre ventrikkel-funksjon og redusert oksygenbehov i løpet av de første 48 timene etter prosedyren. Det var ingen prosedyrerelaterte dødsfall (5). Videre viser en liten prospektiv studie fra Tyskland ingen alvorlige komplikasjoner etter behandling med trombektomi med FlowTriever-systemet hos pasienter med akutt lungeembolisme og påvist høyrebelastning (6).
På vårt sykehus er det implementert responsteam for lungeembolisme (Pulmonary Embolism Response Team, PERT) som raskt og tverrfaglig kan diskutere valg av behandling for lungeembolismepasienter i intermediær høyrisiko- og høyrisikogruppen. Dette er i henhold til anbefalinger i de europeiske kardiologiske retningslinjene om lungeembolisme fra 2019 (2). Vårt team består av hematolog, kardiolog ved ekkolaboratoriet (hjertemedisinsk LIS3-lege på natt) og intervensjonsradiolog.
Kronisk tromboembolisk pulmonal hypertensjon er en potensielt alvorlig komplikasjon til lungeembolisme på sikt. Diagnosen kan tidligst stilles etter tre måneder med adekvat antikoagulasjonsbehandling (7). Symptomer er vedvarende dyspné, som er spesielt uttalt ved fysisk aktivitet, samt fatigue. Kronisk tromboembolisk pulmonal hypertensjon oppstår sekundært til høyre ventrikkel-svikt grunnet kroniske forandringer i lungekarsengen med sekundær hypertrofi og dilatasjon av høyre ventrikkel. Én av flere risikofaktorer for å utvikle pulmonal hypertensjon i forløpet etter akutt lungeembolisme er at tromben eller trombene i akuttsituasjonen var store og lå sentralt (7).
Pasienten i denne kasuistikken ble uten tvil risikostratifisert som høyrisikopasient. Det var klar enighet om initial behandling med systemisk alteplase etter gjeldende nasjonale og internasjonale retningslinjer, da det ikke forelå kontraindikasjoner (2). Intervensjonsteamet rykket ut på mistanken om sentral lungeembolisme og mulig behov for kateterbasert intervensjon, dette fordi alteplase erfaringsmessig kan ha dårligere effekt ved langstrakte og obstruerende tromber.
I akuttmottaket ble jeg overveldet av alle som sto klare, hvordan de var organisert og drillet til minste detalj. Et velorganisert kaos. Jeg følte meg i verdens tryggeste hender. Etter prosedyrene fikk jeg besøk av empatiske og vennlige leger som forklarte med formuleringer jeg forsto og lyttet til. Tårene trillet, det var overveldende. Jeg vet at jeg kunne ha dødd på operasjonsbordet flere ganger.
Jeg vet ikke hvordan jeg kan få takket dere nok.
Avgjørelsen om å gjennomføre enten kirurgisk eller endovaskulær trombektomi hos en høyrisikopasient som vår pasient er enklere enn hos øvrige lungeembolismepasienter, da retningslinjene gir føringer. Det er av stor interesse å kartlegge hvilke pasienter i intermediær høyrisiko-gruppen som også vil være bedre tjent med slike behandlingsmodaliteter enn tradisjonell medikamentell behandling, både på kort sikt (overlevelse), men også på lang sikt når det kommer til hjertefunksjon og risiko for utvikling av kronisk tromboembolisk pulmonal hypertensjon. Per i dag pågår det flere større studier for å kartlegge dette, inkludert studiene PE-TRACT og HI-PEITHO (8, 9).
Pasienten har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Zaidi A, Knight DS, Augustine DX et al. Echocardiographic assessment of the right heart in adults: a practical guideline from the British Society of Echocardiography. Echo Res Pract 2020; 7: G19–41. [PubMed][CrossRef]
- 2.
Konstantinides SV, Meyer G, Becattini C et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Respir J 2019; 54: 1901647. [PubMed][CrossRef]
- 3.
Bryce YC, Perez-Johnston R, Bryce EB et al. Pathophysiology of right ventricular failure in acute pulmonary embolism and chronic thromboembolic pulmonary hypertension: a pictorial essay for the interventional radiologist. Insights Imaging 2019; 10: 18. [PubMed][CrossRef]
- 4.
Carroll BJ, Larnard EA, Pinto DS et al. Percutaneous Management of High-Risk Pulmonary Embolism. Circ Cardiovasc Interv 2023; 16: e012166. [PubMed][CrossRef]
- 5.
Toma C, Jaber WA, Weinberg MD et al. Acute outcomes for the full US cohort of the FLASH mechanical thrombectomy registry in pulmonary embolism. EuroIntervention 2023; 18: 1201–12. [PubMed][CrossRef]
- 6.
Lauder L, Pérez Navarro P, Götzinger F et al. Mechanical thrombectomy in intermediate- and high-risk acute pulmonary embolism: hemodynamic outcomes at three months. Respir Res 2023; 24: 257. [PubMed][CrossRef]
- 7.
Humbert M, Kovacs G, Hoeper MM et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2023; 61: 2200879. [PubMed][CrossRef]
- 8.
Götzinger F, Lauder L, Sharp ASP et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol 2023; 20: 670–84. [PubMed][CrossRef]
- 9.
Klok FA, Piazza G, Sharp ASP et al. Ultrasound-facilitated, catheter-directed thrombolysis vs anticoagulation alone for acute intermediate-high-risk pulmonary embolism: Rationale and design of the HI-PEITHO study. Am Heart J 2022; 251: 43–53. [PubMed][CrossRef]