Myokardfibrose oppstår når hjertets fibroblaster produserer kollagenøst arrvev. Denne prosessen kan primært være reparerende, men får – over tid – ofte negative konsekvenser for pasienten i form av funksjonssvekkelse, sykelighet og dødelighet. Hjerte- og karsykdommer er fortsatt den dominerende dødsårsaken i den vestlige verden (1), og myokardfibrose oppstår i forløpet av mange hjertesykdommer. I denne oversiktsartikkelen presenteres først patofysiologi, klassifikasjon og metoder for påvisning av myokardfibrose. Deretter beskrives noen tilstander hvor myokardfibrose kan påvises, med særlig fokus på aortastenose. Avslutningsvis nevnes fremtidsmuligheter, med fokus på diagnostikk og terapi.
Kunnskapsgrunnlag
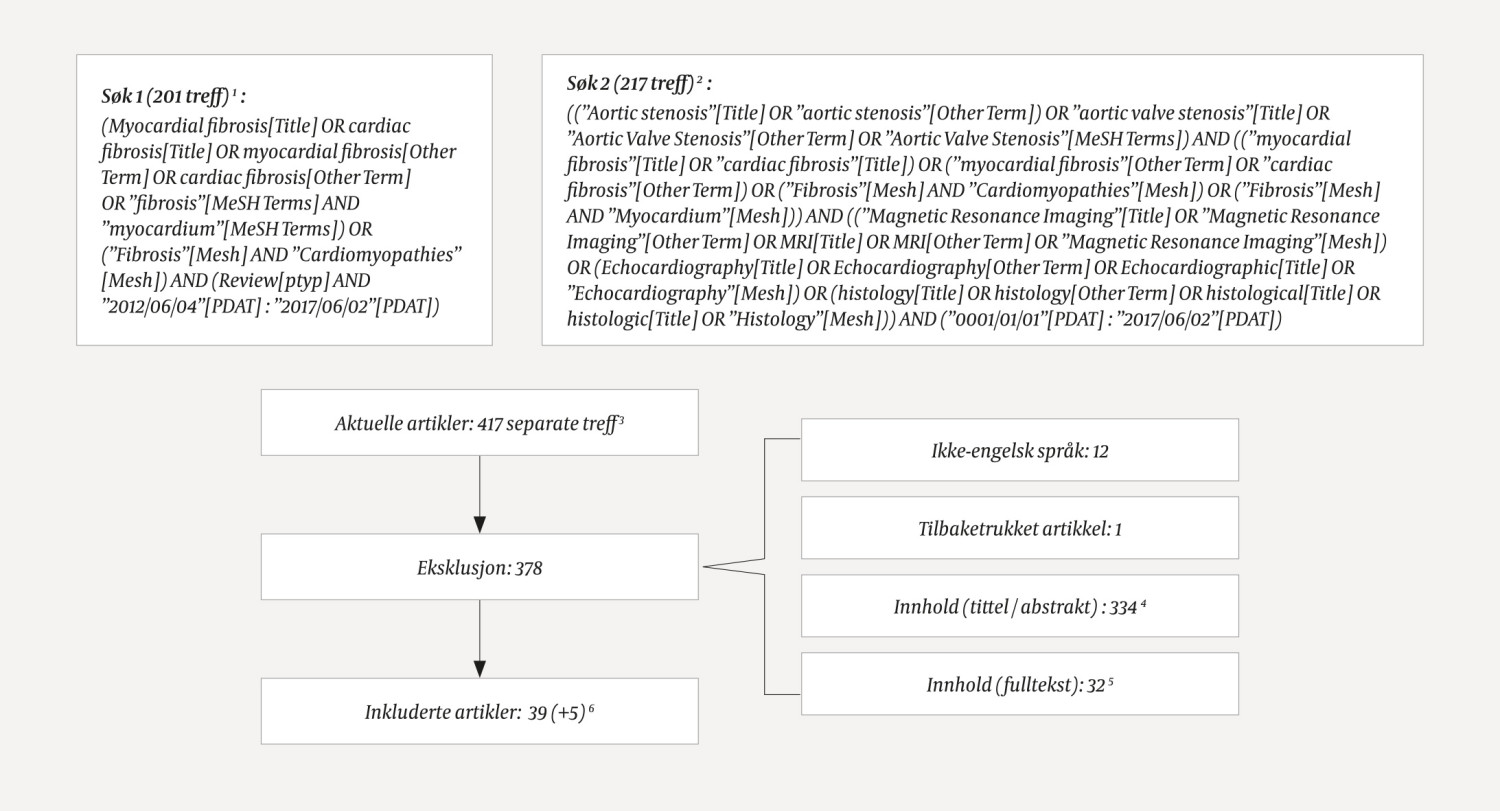
Artikkelen er basert på to supplerende litteratursøk foretatt i PubMed 2.6.2017. Først søkte vi etter oversiktsartikler fra de siste fem årene der begrepet «myocardial fibrosis» eller «cardiac fibrosis» ble benyttet i tittel, MeSH-terms (Medical Subject Headings) eller som other term (forfatters merking av artikkel). I det andre søket flettet vi sammen søk på «aortic stenosis», «myocardial fibrosis» og påvisningsmetoder (hjerte-MR, ekkokardiografi eller histologi, med synonymer). Uten tidsavgrensning søkte vi etter begrepene i tittel, MeSH eller other term. Søkedetaljene med antall treff, ekskluderte og inkluderte artikler er illustrert i figur 1. Av 417 treff ekskluderte førsteforfatter 378 basert på innhold. 5 artikler ble tatt med i tillegg. Til sammen ble 44 artikler inkludert, og alle disse ble lest i fulltekst.
Patofysiologi og klassifikasjon
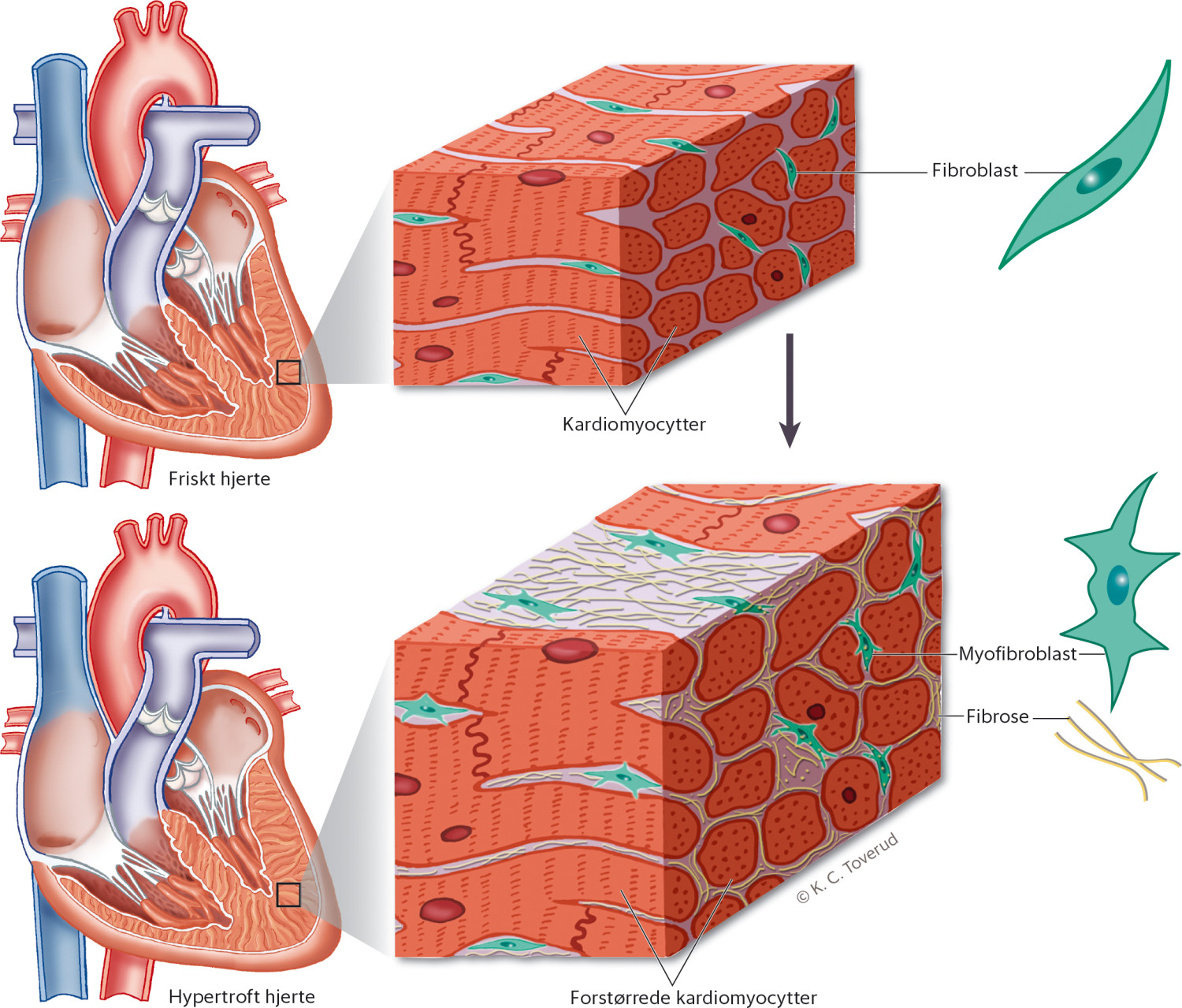
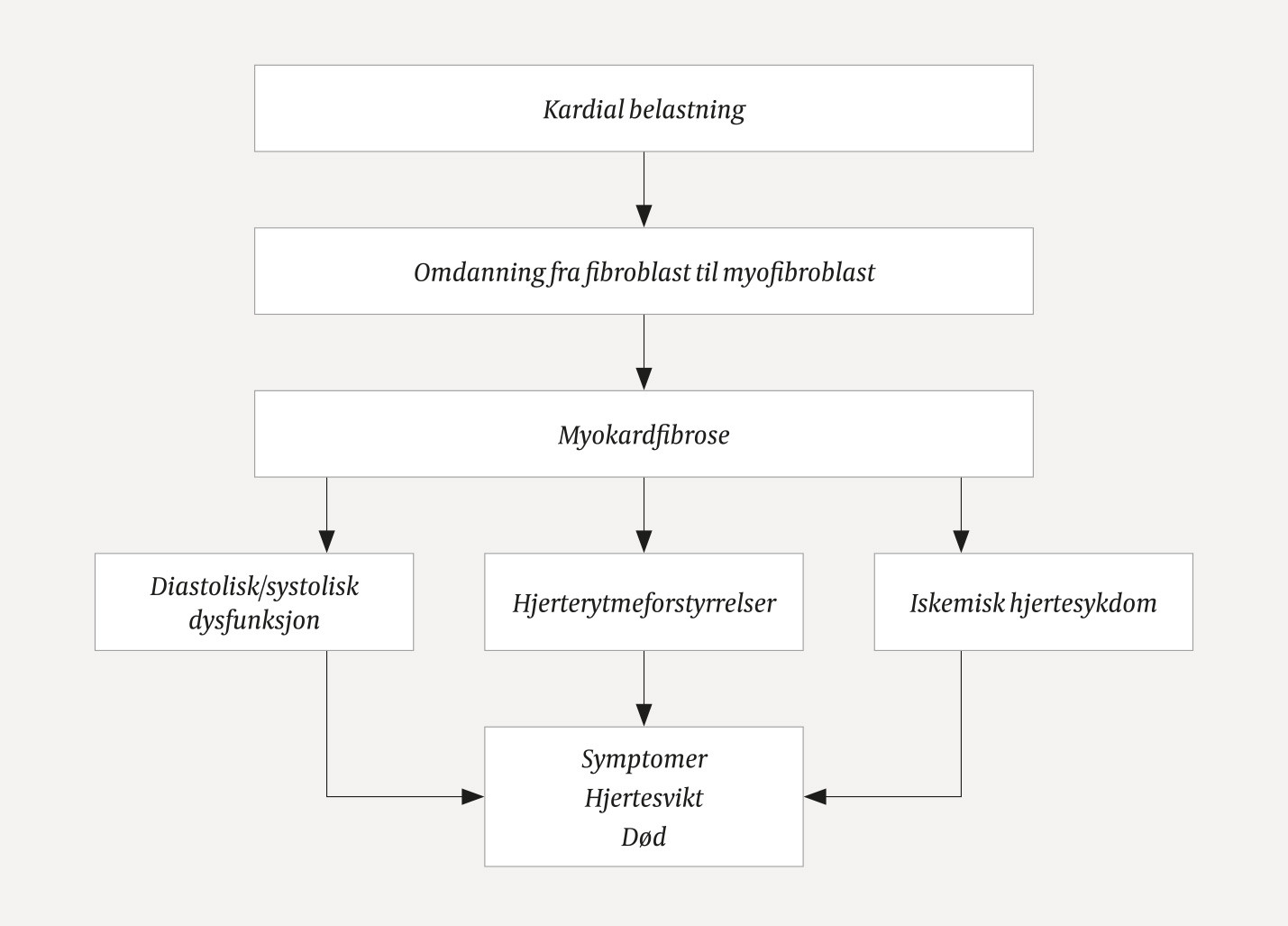
Ved kardial skade og belastning vil ulike substanser bidra til at fibroblaster aktiveres til å bli myofibroblaster (2–7) (figur 2) (8). Myofibroblastene øker produksjonen av proteiner som avsettes i den ekstracellulære matriks (2–5). Kollagen I, som utgjør ca. 80 % av kollagenmengden i myokard, gjør myokard stivere og øker mest ved myokardfibrose (7, 9, 10). Kryssbindinger gjør kollagenmatriksen stivere og vanskeligere å bryte ned med proteinaser (2, 3, 5, 11). Fibrose oppstår ved netto kollagenproduksjon. Fibrosen begrenser tilførselen av oksygen og næring til myokard (2, 3). Myokardfibrose forårsaker elektriske og strukturelle endringer som disponerer for arytmier, hjertesvikt og iskemi (12). Figur 3 oppsummerer patofysiologien og konsekvensene av myokardfibrose.
Fibrose klassifiseres etter årsak og patoanatomi (3, 13). Interstitiell (diffus) fibrose kjennetegnes av diffus kollagenutbredelse elstracellulært uten kardiomyocyttdød (8), og man tror den er reversibel ved tidlig målrettet behandling (3, 7, 14). Diffus fibrose ses hos eldre samt ved hjertesykdommer som aortastenose, kardiomyopatier og kransåresykdom uten infarkt (7, 15). Erstatningsfibrose (arrfibrose) er lokal og oppstår etter kardiomyocyttdød, for eksempel etter hjerteinfarkt. Erstatningsfibrose anses som irreversibel og forebygger hjertemuskelruptur etter hjerteinfarkt (2–4), (4, 10, 13, 14, 16), men kan også oppstå i forløpet av andre sykdommer (3, 5, 7, 14, 16).
Påvisning av myokardfibrose
Biologisk materiale
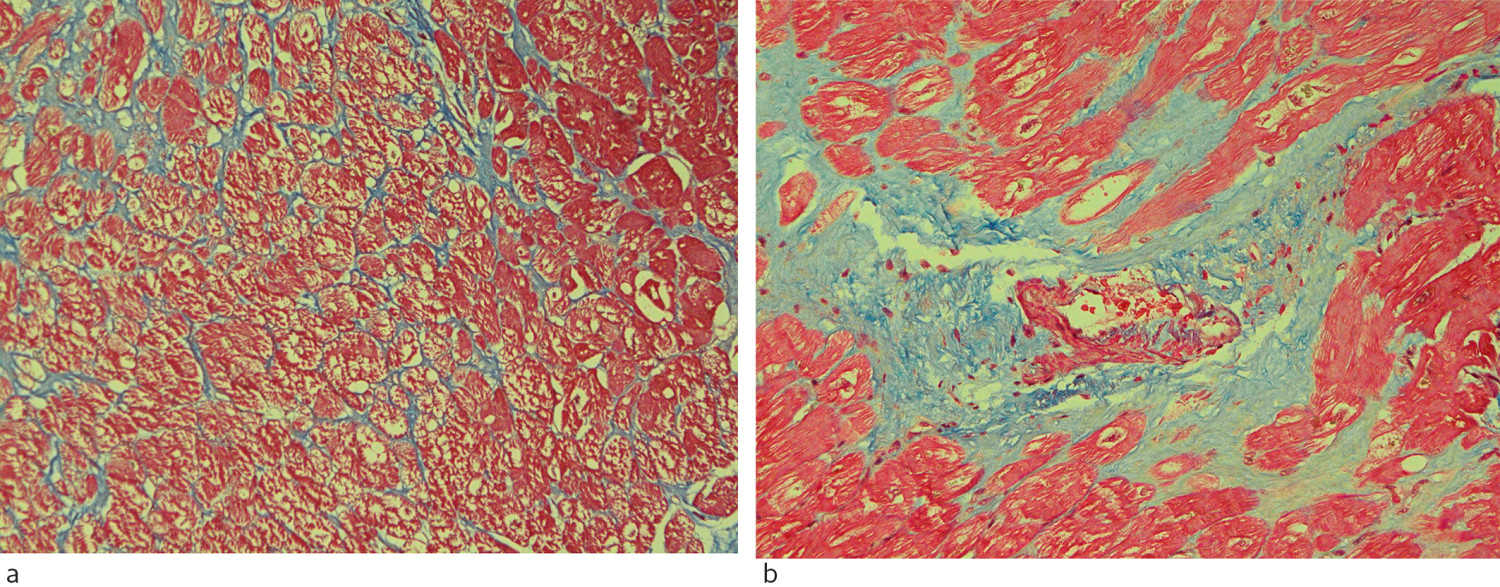
Biomarkører for fibrose kan måles i hjertebiopsier og blodprøver. Hjertebiopsier innhentes fra eksplanterte hjerter samt under myektomi, åpen hjertekirurgi eller kateterbasert endokardbiopsi. Ved hjertebiopsi og bruk av egnede fargemetoder er histologisk analyse av kollagen volumfraksjon regnet som gullstandard for fibrosepåvisning (7, 10, 17). Total kollagenmengde kan kvantiteres, og fibrosens kvalitet (intrastitiell eller erstatningsfibrose) og utbredelse kan beskrives (figur 4). Begrensninger knyttes til mulig ikke-representativ biopsi, kun lokal vurdering, begrenset vevsmengde og prosedyrerelatert risiko (15), (17–19). Moderne molekylærbiologiske metoder kan også benyttes, men bør valideres mot histologi før klinisk bruk (18).
Blodbiomarkører gjenspeiler cellulære og molekylære endringer relatert til fibrotisk vevsmengde (9). C-terminale propeptider av kollagen I og N-terminale propeptider av kollagen III er tilstrekkelig validert (9), og det knyttes optimisme til fremtidig klinisk bruk. Galectin-3 stimulerer aktiveringen av myofibroblaster og utvikling av myokardfibrose (20), men plasmakonsentrasjonen av galectin-3 øker også ved nyresykdom og lever- og lungefibrose (11). Galectin-3-nivå er assosiert med mortalitet og forverret prognose ved hjertesvikt med redusert eller bevart ejeksjonsfraksjon (3, 11).
MR-undersøkelse av hjertet
Hjerte-MR er ikke-invasiv i fravær av kontrastinjeksjon og kartlegger hjertets vevssammensetning og funksjon (10).
T1-relaksometri utføres raskt uten injeksjon av kontrastmiddel, og kan derfor gjennomføres uavhengig av nyrefunksjon (10, 16, 21). Metoden gir informasjon om ødem, fibrose (forlenget T1-relaksasjonstid) og avleiringssykdommer (7, 10, 21), og benyttes klinisk og i forskning ved flere hjertemuskelsykdommer (16, 22).
Ved erstatningsfibrose kan man påvise kvalitative forskjeller i senopptak av gadoliniumholdige kontrastmidler (10, 18). Etter gjennomgått hjerteinfarkt ses økt senopptak forenlig med erstatningsfibrose (figur 5). Ved ikke-iskemiske hjertemuskelsykdommer vil senopptak være assosiert med økt hypertrofi og forverret prognose ved flere tilstander (23, 24). Det er viktig å være klar over at senopptaksmetoden er uegnet for fibrosevurdering ved diffus fibrose med homogent myokard (15, 25).
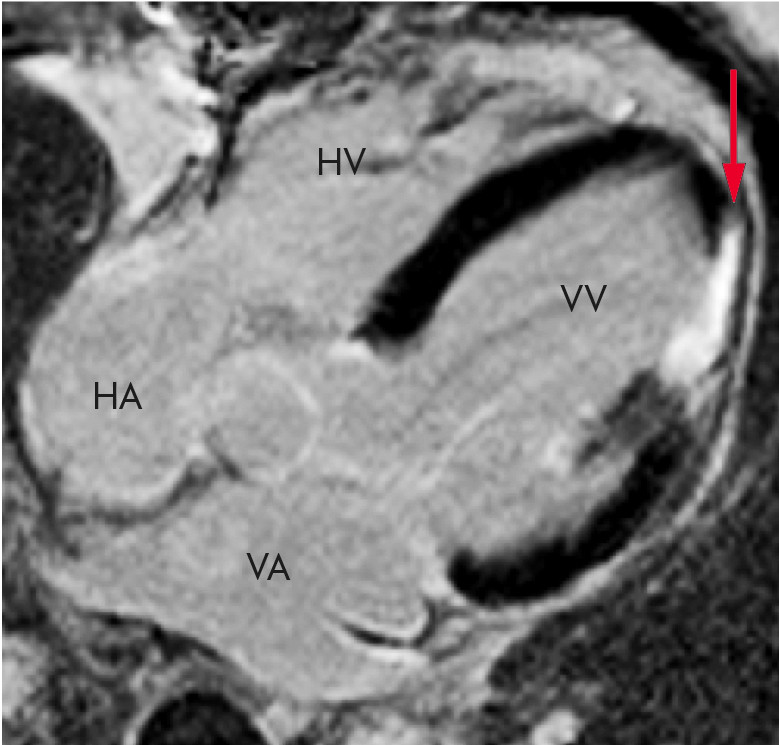
Hjertets ekstracellulære volum kan beregnes basert på T1-relaksometri etter gadoliniuminjeksjon. I fravær av ødem eller amyloidavleiring vil fibrose forklare økt ekstracellulært volum (10, 26). Metoden kan detektere mindre fibrosemengder og har vist bedre korrelasjon med histologisk interstitiell fibrose enn T1-relaksometri og konvensjonell vurdering av senopptak (25). En slik beregning av ekstracellulærvolumet gir stor prognostisk informasjon (10, 21). Ekstracellulært volum bedømt med MR fremstår mer myokardspesifikt enn blodbiomarkører, og kan benyttes til vurdering av intervensjonseffekt (11).
Fibrosebedømming med MR viser god korrelasjon mot histologi (7), (10, 11, 15, 25). Hjerte-MR kan betegnes som en mer praktisk gjennomførbar gullstandard for fibrosepåvisning (11, 26).
CT-undersøkelse av hjertet
Med CT kan arr og annen fibrose påvises svært nøyaktig, men av strålingshygieniske hensyn utføres det sjelden (19). Fibrosevurdering ved hjerte-CT har vist godt samsvar med hjerte-MR-metoder og histologi (17). Metoden vurderes ved kontraindikasjoner mot MR (17) og ved andre indikasjoner for hjerte-CT (27).
Ekkokardiografi
Diffus fibrose endrer bølgeforplantningen og refleksjonsegenskapene i myokard. Disse endringene kan bedømmes ved hjelp av ultralyd. Ekkokardiografi gir tilleggsinformasjon om hjertets struktur og funksjon, og slike parametere er evaluert opp mot MR og histopatologi med hensyn til fibrose (6, 16). Ekkokardiografi er billig og lett tilgjengelig, men vurderingen avhenger av bildekvalitet og operatørerfaring (16, 18).
Tabell 1 oppsummerer de diagnostiske metodenes styrker og svakheter i påvisning av myokardfibrose.
Tabell 1
Fordeler og ulemper ved ulike metoder for å påvise myokardfibrose. Skåring av egnethet eller grad av parameter: I stor (+++), moderat (++), beskjeden (+) eller ingen grad (−). Metodene er veid mot hverandre, basert på forfatternes vurdering.
| Histologi | Blodprøver | MR | CT | Ekkokardiografi | |
|---|---|---|---|---|---|
| Direkte fibrosepåvisning 1 | +++ | − | ++(+) | + | + |
| Vurdering av hjertets funksjon | − | − | +++ 2 | ++ | +++ 2 |
| Ressurskrevende (tid/kostnader) | +++ | − | ++ | + | + |
| Tilgjengelighet | − | +++ | + | ++ | ++ |
| Komplikasjonsrisiko | +(+) 3 | (+) | + | + | − |
| Stråling | − 3 | − | − | +++ | − |
| Krever mye opplæring | +++ | + | ++(+) | ++ | +++ |
1Histologi er gullstandard, mens MR oppfattes som noninvasiv gullstandard. De andre metodene skåres etter validering mot gullstandard.
2Omtrent likeverdige som gullstandard for vurdering av hjertets funksjon i forhold til fibrosens konsekvenser.
3Forutsatt vevsprøvetaking under åpen hjertekirurgi.
Myokardfibrose ved ulike sykdomstilstander
Myokardfibrose er assosiert med økt myokardstivhet, kardiomyocyttdød, arytmier, plutselig hjertedød og ugunstig prognose (2, 3, 17, 18, 23, 28), og er sentral i remodelleringsprosessen som leder til hjertesvikt (10, 17, 26). Kransåresykdom, aortastenose og hypertensjon utgjør de hyppigste årsakene til myokardfibrose (13). Aortastenose og hypertensjon gir trykkoverbelastning av venstre ventrikkel. Påfølgende økt veggstress induserer hypertrofi og interstitiell fibrose (2–4). Kronisk trykkoverbelastning kan forårsake kardiomyocyttdød og erstatningsfibrose (22, 29).
Aortastenose
Ved aortastenose kan histologisk fibrose (interstitiell og erstatningsfibrose) utgjøre opp mot 30 % av vevsvolumet (14). Både interstitiell fibrose og erstatningsfibrose kan finnes hos samme individ. MR-studier viser at interstitiell fibrose dominerer tidlig i forløpet, mens erstatningsfibrose kan ses hos opptil 60 % av pasientene (14, 19). Fibrose oppstår oftest subendokardialt og i midtveggen, med størst utbredelse i basale septum av venstre ventrikkel (10, 28, 30). Lokal veggbelastning og økt veggtykkelse (med iskemirisiko) kan forklare dette.
Ved aortastenose er fibroseomfanget assosiert med symptomintensitet, redusert hjertefunksjon og fysisk kapasitet samt økt dødelighet (10, 22, 23, 28)(28–32). Omfattende erstatningsfibrose før klaffekirurgi predikerer ugunstig postoperativt resultat (23), (29–31), (33). Kirurgisk behandling av alvorlig aortastenose anbefales ved symptomer, nedsatt ejeksjonsfraksjon eller samtidig med annen hjertekirurgi (34). Preoperativ vurdering har imidlertid sine utfordringer (27). Klaffekirurgi bør vurderes før irreversibel fibrose eller funksjonsnedsettelse oppstår, da tidlig klaffekirurgi kan bedre prognosen hos asymptomatiske pasienter med bevart ejeksjonsfraksjon (23, 29). Bildediagnostikk, blodbiomarkører og risikokalkulatorer kan i fremtiden bidra til optimalisering av pasientseleksjon og tidspunkt for klaffekirurgi (31, 33).
Hypertensjon
Ved hypertensiv hjertesykdom vil interstitiell fibrose være prognostisk ugunstig og bidra til kardial dysfunksjon, kransåresykdom og arytmier (35). Hjerte-MR kan predikere fremtidig dekompensasjon (10). Fibroseomfanget er begrenset ved isolert hypertensjon, men øker ved samtidig hypertrofi (36) eller kronisk nyresykdom (16). Hypertensive pasienter kan benytte hemmere av renin-angiotensin-aldosteron-systemet som har antifibrotiske egenskaper (36). Blodtrykksreduksjon kan gi tilbakegang av interstitiell fibrose.
Hypertrofisk kardiomyopati
Hypertrofisk kardiomyopati er en genetisk sykdom som kan gi omfattende myokardfibrose (37) (figur 4). Fibrose og ledsagende funksjonssvekkelse er ofte størst i basale septum (38). Høyt senopptak av kontrastmiddel ved MR er assosiert med økt risiko for plutselig hjertedød. (39). Interstitiell fibrose er sterkere assosiert med arytmier enn erstatningsfibrose (37).
Kardial amyloidose
Kardial amyloidose, som også betegnes som infiltrerende interstitiell fibrose (7, 16), innebærer amyloidavleiring i myokard. Tilstanden oppstår, i motsetning til tradisjonell myokardfibrose, uavhengig av kardial belastning (11). Ved kardial amyloidose kan EKG og bildeundersøkelser gi funn som ligner myokardfibrose (hhv. lav spenning og hypertrofi- og fibrosefunn). Ulike biomarkører og MR kan skille tilstandene. Kardial amyloidose forårsaker alvorlig hjertesvikt med dårlig prognose (26).
Iskemisk hjertesykdom og dilatert kardiomyopati
Ikke-iskemisk dilatert kardiomyopati og iskemisk hjertesykdom er de to hyppigste årsakene til hjertesvikt og hjertetransplantasjon. Økt mengde erstatningsfibrose, påvist ved MR, knyttes til dårlig prognose og alvorlige arytmier (7). Fibrose ved dilatert kardiomyopati er som oftest lokalisert i midtveggen med flekkvis eller diffus fordeling (7). Iskemisk erstatningsfibrose er lokalisert transmuralt eller subendokardielt med regional utbredelse tilsvarende kransårenes anatomi, og kan påvises ved MR (7). Etter transmurale hjerteinfarkt kan myokard fremstå stillestående, fortynnet og med økt ekkogenisitet ved ekkokardiografi.
Atrieflimmer
Ved atrieflimmer ses økt mengde atriefibrose. Alvorlig atriefibrose er assosiert med hyppigere anfall med atrieflimmer, embolisk hjerneinfarkt og dårligere effekt av antiarytmika og radiofrekvensablasjon (6, 40, 41). Atriefibrose kan til en viss grad påvises med ekkokardiografi og MR, der kun MR er validert mot histologi (40, 41).
Andre tilstander
Fibrose er prognostisk ugunstig ved aortainsuffisiens. En studie fant at fibroseutbredelse ved alvorlig aortainsuffisiens ligner på fibrosen ved alvorlig aortastenose (31).
Myokardfibrose ses ved alvorlig nyresvikt, særlig blant pasienter under behandling med hemodialyse. Nyretransplanterte har mindre myokardfibrose enn pasienter som mottar hemodialyse, og tilbakegang av myokardfibrose har blitt observert etter transplantasjon (16).
Diabetisk kardiomyopati kjennetegnes ved tidlig utvikling av diastolisk dysfunksjon, hypertrofi og diffus fibrose (42). Diabetikere har høyere ekstracellulært volum bedømt ved MR med senopptak og forhøyet risiko for død eller hospitalisering ved hjertesvikt (26).
Fysiologisk hypertrofi ved trening og svangerskap er reversibel og forårsaker normalt ikke fibrose (3). Fibrose kan dog ses hos eldre atleter. Ved myokardfibrose hos unge atleter bør underliggende kardiomyopati vurderes (43).
Fremtid og terapeutiske muligheter
Det pågår intens forskning for å finne medikamenter som reverserer eller bremser utviklingen av myokardfibrose, ettersom disse antas å kunne revolusjonere behandlingen av hjertesvikt (2, 4, 11). To hovedstrategier for fibrosereduksjon er hemming av profibrotiske eller stimulering av antifibrotiske molekyler (5). Transformerende vekstfaktor-β (TGF-β) og galectin-3 er sentrale i utviklingen av myokardfibrose (2, 4, 20), og fibrose mediert av angiotensin II og aldosteron avhenger delvis av disse molekylene (7, 44). Hemming av transformerende vekstfaktor-β og galectin-3 har vist antifibrotisk effekt (2, 44). Hemmere av renin-angiotensin-aldosteron-systemet bremser fibroseutviklingen og kan delvis forklare medikamentenes effekt ved hjertesvikt og hypertensjon (2, 4, 5, 11).
Det er viktig med forebygging og effektiv behandling av etablert hjertesykdom etter retningslinjer for å begrense utvikling av fibrose (45).
Konklusjon
Moderne biomarkører og bildediagnostikk har bedret forståelsen av myokardfibrose og dens prognostiske betydning ved flere hjertesykdommer. Bedre metoder for påvisning, økt forståelse av sentrale molekylære signalveier samt potensiell antifibrotisk behandling er sentrale forskningsfokus (12). Vurdering av myokardfibrose vil sannsynligvis få større plass i diagnostikk, risikostratifisering og behandling av hjertesykdommer i fremtiden.
Takk til Katrine Aronsen ved Universitetsbiblioteket i Trondheim for bidrag i litteratursøket og stipendiat Erik Andreas Rye Berg ved NTNU for verdifulle innspill.
Hovedbudskap
Myokardfibrose defineres som økt mengde kollagenøst arrvev i hjertet
Myokardfibrose kan oppstå ved hjertesykdommer og ved ekstrakardiale sykdommer
Myokardfibrose er prognostisk ugunstig
Moderne diagnostikk gjør at man i større grad kan påvise myokardfibrose
- 1.
Townsend N, Wilson L, Bhatnagar P et al. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J 2016; 37: 3232 - 45. [PubMed][CrossRef]
- 2.
Travers JG, Kamal FA, Robbins J et al. Cardiac fibrosis: the fibroblast awakens. Circ Res 2016; 118: 1021 - 40. [PubMed][CrossRef]
- 3.
Piek A, de Boer RA, Silljé HH. The fibrosis-cell death axis in heart failure. Heart Fail Rev 2016; 21: 199 - 211. [PubMed][CrossRef]
- 4.
Kong P, Christia P, Frangogiannis NG. The pathogenesis of cardiac fibrosis. Cell Mol Life Sci 2014; 71: 549 - 74. [PubMed][CrossRef]
- 5.
Talman V, Ruskoaho H. Cardiac fibrosis in myocardial infarction-from repair and remodeling to regeneration. Cell Tissue Res 2016; 365: 563 - 81. [PubMed][CrossRef]
- 6.
Dzeshka MS, Lip GY, Snezhitskiy V et al. Cardiac fibrosis in patients with atrial fibrillation: mechanisms and clinical implications. J Am Coll Cardiol 2015; 66: 943 - 59. [PubMed][CrossRef]
- 7.
Barison A, Grigoratos C, Todiere G et al. Myocardial interstitial remodelling in non-ischaemic dilated cardiomyopathy: insights from cardiovascular magnetic resonance. Heart Fail Rev 2015; 20: 731 - 49. [PubMed][CrossRef]
- 8.
Herum KM, Lunde IG, McCulloch AD et al. The soft- and hard-heartedness of cardiac fibroblasts: mechanotransduction signaling pathways in fibrosis of the heart. J Clin Med 2017; 6: E53. [PubMed][CrossRef]
- 9.
López B, González A, Ravassa S et al. Circulating biomarkers of myocardial fibrosis: the need for a reappraisal. J Am Coll Cardiol 2015; 65: 2449 - 56. [PubMed][CrossRef]
- 10.
Everett RJ, Stirrat CG, Semple SI et al. Assessment of myocardial fibrosis with T1 mapping MRI. Clin Radiol 2016; 71: 768 - 78. [PubMed][CrossRef]
- 11.
Schelbert EB, Fonarow GC, Bonow RO et al. Therapeutic targets in heart failure: refocusing on the myocardial interstitium. J Am Coll Cardiol 2014; 63: 2188 - 98. [PubMed][CrossRef]
- 12.
Heymans S, González A, Pizard A et al. Searching for new mechanisms of myocardial fibrosis with diagnostic and/or therapeutic potential. Eur J Heart Fail 2015; 17: 764 - 71. [PubMed][CrossRef]
- 13.
Zeisberg M, Kalluri R. Cellular mechanisms of tissue fibrosis. 1. Common and organ-specific mechanisms associated with tissue fibrosis. Am J Physiol Cell Physiol 2013; 304: C216 - 25. [PubMed][CrossRef]
- 14.
Chin CW, Vassiliou V, Jenkins WS et al. Markers of left ventricular decompensation in aortic stenosis. Expert Rev Cardiovasc Ther 2014; 12: 901 - 12. [PubMed][CrossRef]
- 15.
Flett AS, Hayward MP, Ashworth MT et al. Equilibrium contrast cardiovascular magnetic resonance for the measurement of diffuse myocardial fibrosis: preliminary validation in humans. Circulation 2010; 122: 138 - 44. [PubMed][CrossRef]
- 16.
Graham-Brown MP, Patel AS, Stensel DJ et al. Imaging of myocardial fibrosis in patients with end-stage renal disease: current limitations and future possibilities. BioMed Res Int 2017; 2017: 5453606. [PubMed][CrossRef]
- 17.
Pattanayak P, Bleumke DA. Tissue characterization of the myocardium: state of the art characterization by magnetic resonance and computed tomography imaging. Radiol Clin North Am 2015; 53: 413 - 23. [PubMed][CrossRef]
- 18.
Sado DM, Flett AS, Moon JC. Novel imaging techniques for diffuse myocardial fibrosis. Future Cardiol 2011; 7: 643 - 50. [PubMed][CrossRef]
- 19.
Badiani S, van Zalen J, Treibel TA et al. Aortic stenosis, a left ventricular disease: insights from advanced imaging. Curr Cardiol Rep 2016; 18: 80. [PubMed][CrossRef]
- 20.
Hundae A, McCullough PA. Cardiac and renal fibrosis in chronic cardiorenal syndromes. Nephron Clin Pract 2014; 127: 106 - 12. [PubMed][CrossRef]
- 21.
Moon JC, Messroghli DR, Kellman P et al. Myocardial T1 mapping and extracellular volume quantification: a Society for Cardiovascular Magnetic Resonance (SCMR) and CMR Working Group of the European Society of Cardiology consensus statement. J Cardiovasc Magn Reson 2013; 15: 92. [PubMed][CrossRef]
- 22.
Chin CWL, Everett RJ, Kwiecinski J et al. Myocardial fibrosis and cardiac decompensation in aortic stenosis. JACC Cardiovasc Imaging 2017; 10: 1320 - 33. [PubMed][CrossRef]
- 23.
Quarto C, Dweck MR, Murigu T et al. Late gadolinium enhancement as a potential marker of increased perioperative risk in aortic valve replacement. Interact Cardiovasc Thorac Surg 2012; 15: 45 - 50. [PubMed][CrossRef]
- 24.
Rudolph A, Abdel-Aty H, Bohl S et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy relation to remodeling. J Am Coll Cardiol 2009; 53: 284 - 91. [PubMed][CrossRef]
- 25.
de Meester de Ravenstein C, Bouzin C, Lazam S et al. Histological Validation of measurement of diffuse interstitial myocardial fibrosis by myocardial extravascular volume fraction from Modified Look-Locker imaging (MOLLI) T1 mapping at 3 T. J Cardiovasc Magn Reson 2015; 17: 48. [PubMed][CrossRef]
- 26.
Bulluck H, Maestrini V, Rosmini S et al. Myocardial T1 mapping. Circ J 2015; 79: 487 - 94. [PubMed][CrossRef]
- 27.
Chin CW, Pawade TA, Newby DE et al. Risk stratification in patients with aortic stenosis using novel imaging approaches. Circ Cardiovasc Imaging 2015; 8: e003421. [PubMed][CrossRef]
- 28.
Dweck MR, Joshi S, Murigu T et al. Midwall fibrosis is an independent predictor of mortality in patients with aortic stenosis. J Am Coll Cardiol 2011; 58: 1271 - 9. [PubMed][CrossRef]
- 29.
Milano AD, Faggian G, Dodonov M et al. Prognostic value of myocardial fibrosis in patients with severe aortic valve stenosis. J Thorac Cardiovasc Surg 2012; 144: 830 - 7. [PubMed][CrossRef]
- 30.
Weidemann F, Herrmann S, Störk S et al. Impact of myocardial fibrosis in patients with symptomatic severe aortic stenosis. Circulation 2009; 120: 577 - 84. [PubMed][CrossRef]
- 31.
Azevedo CF, Nigri M, Higuchi ML et al. Prognostic significance of myocardial fibrosis quantification by histopathology and magnetic resonance imaging in patients with severe aortic valve disease. J Am Coll Cardiol 2010; 56: 278 - 87. [PubMed][CrossRef]
- 32.
Flett AS, Sado DM, Quarta G et al. Diffuse myocardial fibrosis in severe aortic stenosis: an equilibrium contrast cardiovascular magnetic resonance study. Eur Heart J Cardiovasc Imaging 2012; 13: 819 - 26. [PubMed][CrossRef]
- 33.
Chin CW, Messika-Zeitoun D, Shah AS et al. A clinical risk score of myocardial fibrosis predicts adverse outcomes in aortic stenosis. Eur Heart J 2016; 37: 713 - 23. [PubMed][CrossRef]
- 34.
Baumgartner H, Falk V, Bax JJ et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38: 2739 - 91. [PubMed][CrossRef]
- 35.
Moreno MU, Eiros R, Gavira JJ et al. The hypertensive myocardium: from microscopic lesions to clinical complications and outcomes. Med Clin North Am 2017; 101: 43 - 52. [PubMed][CrossRef]
- 36.
Treibel TA, Zemrak F, Sado DM et al. Extracellular volume quantification in isolated hypertension - changes at the detectable limits? J Cardiovasc Magn Reson 2015; 17: 74. [PubMed][CrossRef]
- 37.
Almaas VM, Haugaa KH, Strøm EH et al. Increased amount of interstitial fibrosis predicts ventricular arrhythmias, and is associated with reduced myocardial septal function in patients with obstructive hypertrophic cardiomyopathy. Europace 2013; 15: 1319 - 27. [PubMed][CrossRef]
- 38.
Doesch C, Sperb A, Sudarski S et al. Mitral annular plane systolic excursion is an easy tool for fibrosis detection by late gadolinium enhancement cardiovascular magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Arch Cardiovasc Dis 2015; 108: 356 - 66. [PubMed][CrossRef]
- 39.
Briasoulis A, Mallikethi-Reddy S, Palla M et al. Myocardial fibrosis on cardiac magnetic resonance and cardiac outcomes in hypertrophic cardiomyopathy: a meta-analysis. Heart 2015; 101: 1406 - 11. [PubMed][CrossRef]
- 40.
Hirsh BJ, Copeland-Halperin RS, Halperin JL. Fibrotic atrial cardiomyopathy, atrial fibrillation, and thromboembolism: mechanistic links and clinical inferences. J Am Coll Cardiol 2015; 65: 2239 - 51. [PubMed][CrossRef]
- 41.
Akoum N, Marrouche N. Assessment and impact of cardiac fibrosis on atrial fibrillation. Curr Cardiol Rep 2014; 16: 518. [PubMed][CrossRef]
- 42.
Huynh K, Bernardo BC, McMullen JR et al. Diabetic cardiomyopathy: mechanisms and new treatment strategies targeting antioxidant signaling pathways. Pharmacol Ther 2014; 142: 375 - 415. [PubMed][CrossRef]
- 43.
Waterhouse DF, Ismail TF, Prasad SK et al. Imaging focal and interstitial fibrosis with cardiovascular magnetic resonance in athletes with left ventricular hypertrophy: implications for sporting participation. Br J Sports Med 2012; 46 (suppl 1): i69 - 77. [PubMed][CrossRef]
- 44.
Calvier L, Miana M, Reboul P et al. Galectin-3 mediates aldosterone-induced vascular fibrosis. Arterioscler Thromb Vasc Biol 2013; 33: 67 - 75. [PubMed][CrossRef]
- 45.
Broberg CS, Burchill LJ. Myocardial factor revisited: The importance of myocardial fibrosis in adults with congenital heart disease. Int J Cardiol 2015; 189: 204 - 10. [PubMed][CrossRef]
Torvald Espeland og kolleger har skrevet en verdifull og interessant oversikt over myokardfibrose, men utelater å nevne et viktig kardiologisk fagfelt ved myokardfibrose, nemlig medfødte hjertefeil hos både barn og voksne. Medfødt hjertefeil forekommer hos ca. 1% av nyfødte. Langtidskomplikasjoner hos undergrupper med medfødte hjertefeil rammer derfor et betydelig antall pasienter, ofte i relativt ung alder.
I flere tiår har man hatt kunnskapen om fibroseutvikling som en bekymringsverdig langtidskomplikasjon tross kirurgisk reparasjon av hjertefeilen tidlig i livet (1). Fibroseutviklingen synes hos disse pasientene ikke kun å være knyttet til hjertefeilens alvorlighetsgrad eller cyanose, men også til genetiske faktorer. Myokardfibrose er en viktig medvirkende årsak til hjertesviktutvikling hos voksne med medfødte hjertefeil (2). Hos pasienter med enkel ventrikkel bidrar tidlig fibroseutvikling sannsynligvis til pumpesvikt i barnealder (3).
MR-undersøkelse med T1-mapping og beregning av ekstracellulært volum kan gi unik informasjon om myokard og grad av diffus fibrose, men er noe mer komplisert å bruke enn angitt i artikkelen. Metoden for T1-mapping er maskinspesifikk og ennå ikke helt standardisert for klinisk bruk. T1-relaksasjonstiden påvirkes av flere faktorer og forskjellige tekniske parametre, og ekstracellulært volum anses som en mer robust parameter. Derfor er det anbefalt å etablere lokale referanseverdier for å oppnå reproduserbare målinger av god kvalitet (4). Økt diffus myokardfibrose er påvist med T1-mapping ved ulike typer hjertefeil som Fallots tetrade, medfødt aortastenose, enkel ventrikkel og transposisjon av de store arterier (5).
Myokardfibrose er en viktig faktor for utvikling av nedsatt myokardfunksjon ved ervervede og medfødte hjertesykdommer. Korrekt anvendt kan MR-teknikker hjelpe med å forstå og kartlegge fibroseprosessen.
Litteratur:
1. Rathod RH, Powell AJ, Geva T. Myocardial Fibrosis in Congenital Heart Disease. Circ J 2016; 80: 1300-7.
2. Broberg CS, Burchill LJ. Myocardial factor revisited: The importance of myocardial fibrosis in adults with congenital heart disease. Int J Cardiol 2015; 189: 204-10.
3. Sugimoto M, Saiki H, Tamai A et al. Ventricular fibrogenesis activity assessed by serum levels of procollagen type III N-terminal amino peptide during the staged Fontan procedure. J Thorac Cardiovasc Surg 2016; 151: 1518-26.
4. Messroghli DR, Moon JC, Ferreira VM et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J Cardiovasc Magn Reson 2017; 19: 75.
5. Riesenkampff E, Messroghli DR, Redington AN et al. Myocardial T1 mapping in pediatric and congenital heart disease. Circ Cardiovasc Imaging 2015; 8: e002504.
Vi vil gjerne takke for relevant kommentar til vår artikkel om myokardfibrose. Pålagt begrensning på artikkelens størrelse medførte at vi måtte utelate flere viktige tema. Vi valgte derfor å fokusere på klassifisering, patofysiologi og påvisningsmuligheter og omtale noen sentrale sykdomstilstander. I første innsendte versjon var imidlertid også pasienter med medfødt hjertefeil inkludert, og vi er glade for at denne pasientgruppen igjen får oppmerksomhet.
Pasienter med medfødt hjertefeil har ofte alvorlig hjertesykdom som påvirker pasienten gjennom hele livsløpet (1). Möller og de Lange nevner at myokardfibrose medvirker til hjertesviktutvikling hos voksne med medfødt hjertefeil, og at genetiske forhold påvirker fibroseomfang blant pasienter med medfødte hjertefeil. Genetiske forhold spiller trolig også en rolle for hvordan ervervet hjertesykdom fører til utvikling av myokardfibrose, både med tanke på type og mengde fibrose. Individvariasjoner forklares neppe av forskjeller i sykdomsbelastning alene. Fibrose står sentralt i utviklingen av nedsatt hjertefunksjon og disponerer for arytmier ved mange hjertesykdommer.
Flere sykdomstilstander hadde fortjent omtale i artikkelen. Vi vil i tillegg nevne kreftoverlevere som har gjennomgått kardiotoksisk kjemoterapi eller strålebehandling mot brystregionen. Med bedret kreftoverlevelse vil denne pasientgruppen øke, og de vil ha økt risiko for å utvikle fibrose i myokard og hjertet forøvrig. Slike bivirkninger vil ofte påvirke livskvalitet, sykelighet og dødelighet (2).
Videre påpeker Möller og de Lange at ekstracellulært volum anses som en mer robust parameter enn nativ T1-mapping. Dette er vi enige i, og metoden har som nevnt høyt samsvar med histologisk interstitiell fibrose. I tillegg til lokale referanseverdier kreves hematokritmåling for standard beregning av ekstracellulært volum. For å unngå endringer i erytrocyttvolumfraksjon er det ønskelig med kortest mulig tid mellom blodprøvetaking og MR-undersøkelse. Utvikling av medisinsk teknologi har de siste årene muliggjort syntetisk beregning av ekstracellulær volum, med avledning av denne verdien basert på blodets egen T1-verdi (3). Det er ingen tvil om at MR har bidratt til økt forståelse og bedre kartlegging av myokardfibrose.
Litteratur
1. Broberg CS, Burchill LJ. Myocardial factor revisited: The importance of myocardial fibrosis in adults with congenital heart disease. Int J Cardiol 2015; 189: 204-10.
2. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016; 37: 2768-801.
3. Messroghli DR, Moon JC, Ferreira VM, et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J Cardiovasc Magn Reson 2017; 19: 75.