Sekkebegrepet frontotemporal demens favner om flere nevrodegenerative sykdommer, som fører til tap av hjerneceller i frontallappene og/eller temporallappene (1). Frontotemporal demens kan deles inn i to fenotypiske grupper etter endringer enten i atferd eller språk. Atferdsvarianten utgjør omtrent halvparten av alle tilfellene og innebærer endret atferd og personlighet (2). Atferdsvarianten karakteriseres av fokal og fremtredende frontal atrofi. Språkvarianten kalles primær progressiv afasi og består av tre undergrupper: ikke-flytende variant (kjent som progressiv ikke-flytende afasi), semantisk variant (kjent som semantisk demens) og logopenisk variant (kjent som logopenisk afasi) (3–5). Den semantiske varianten er karakterisert ved bilateral anterior temporallappatrofi og er assosiert med språkforstyrrelser, tvangshandlinger og dysfunksjon i emosjonell prosessering (3). Frontotemporal demens overlapper med andre nevrodegenerative sykdommer som progressiv supranukleær parese, kortikobasal degenerasjon og atferdsvariant av frontotemporal demens med motornevronsykdom (6) (ramme 1).
Følgende sykdommer omfattes av begrepet (3–6):
-
Atferdsvarianten. Utgjør omtrent halvparten av alle frontotemporal demens-tilfeller og innebærer endret atferd og personlighet
-
Språkvarianten (primær progressiv afasi). Består av tre subtyper:
-
ikke flytende variant (progressiv ikke-flytende afasi)
-
semantisk variant (semantisk demens)
-
logopenisk variant (logopenisk afasi)
-
Frontotemporal demens overlapper også med andre nevrodegenerative sykdommer:
-
Progressiv supranukleær parese
-
Kortikobasal degenerasjon
-
Atferdsvarianten av frontotemporal demens med motornevronsykdom
Mange med frontotemporal demens debuterer med symptomer i 50–60-årene, og i enkelte tilfeller kan personer rammes ned i 30–40-årene (7). Det kan ta opptil fem år fra de første symptomene oppstår til diagnosen blir satt (8, 9), og det finnes per i dag ingen kurativ behandling (10). Risikofaktorer for demens kan deles inn i modifiserbare og ikke-modifiserbare (11). Kunnskap om modifiserbare risikofaktorer er viktig for klinikere som ønsker å tilby pasienter råd om hvordan de kan forebygge eller redusere risikoen for å bli rammet av en demenssykdom.
Frontotemporal demens er en av de vanligste demensformene hos yngre under 65 år (4). Det anslås at denne typen utgjør omtrent 10 % av alle slike tilfeller (12). Forekomsten av demens før 65 år er i Norge estimert til å være 1 200–1 400 personer, men det finnes ikke oppdaterte tall på insidens og prevalens hos yngre personer (8). Arv er en av de største risikofaktorene for frontotemporal demens, men opptil 60 % av de rammede har ingen kjente familiemedlemmer med tilstanden (13). Dette tyder på at 6 av 10 personer blir sporadisk rammet (ikke-arvelige tilfeller) (13). Frontotemporal demens er knyttet til kromosom 17 i enkelte familier, med autosomalt dominant arvemønster. I andre tilfeller er sykdommen knyttet til kromosom 3 og 9. Mutasjoner i tau-genet er også påvist i enkelte tilfeller (14). Kunnskap om modifiserbare risikofaktorer for frontotemporal demens kan derfor spille vesentlig rolle i forståelsen av hvem som blir rammet.
Formålet med artikkelen var å gi en oppdatert oversikt over modifiserbare risikofaktorer for frontotemporal demens samt å vurdere om kunnskapsgrunnlaget er tilstrekkelig for å fremme kliniske anbefalinger for å redusere risikoen.
Kunnskapsgrunnlag
Vi utførte et systematisk søk i basene PsychInfo, Embase, PubMed og Cochrane. Søkeord som ble brukt var «frontotemporal degeneration», «frontotemporal dementia», «frontotemporal lobar degeneration», «dementia» og «risk factors» som MeSH-emneord og søkeord. Søket var begrenset til artikler som var publisert i tidsrommet 1.1.2005–24.1.2017. Søket ble filtrert etter følgende språk: norsk, dansk, svensk og engelsk.
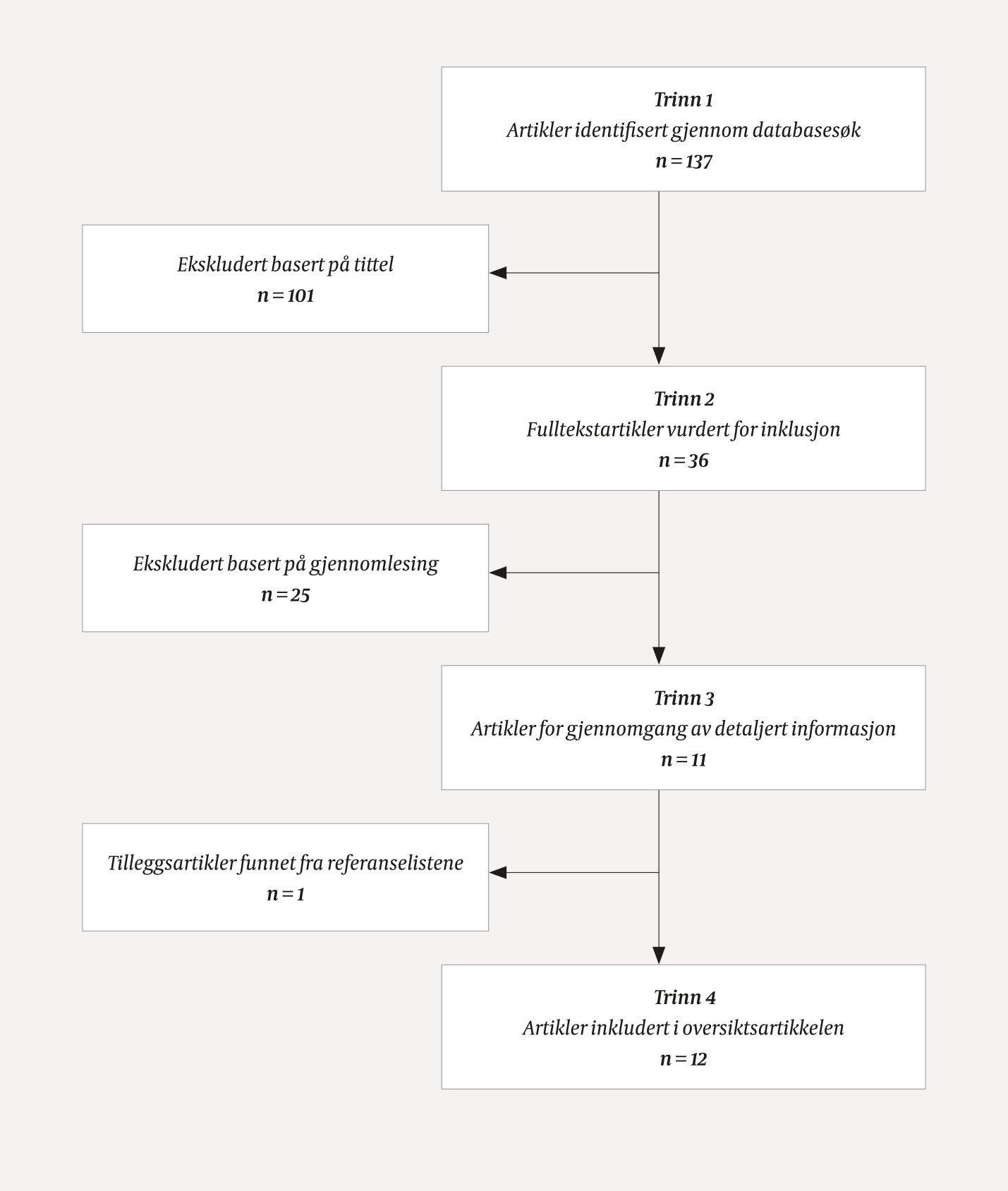
Inklusjonskriteriene var oversiktsartikler og originalstudier med data om modifiserbare risikofaktorer for frontotemporal demens. Studier som omhandlet ikke-modifiserbare risikofaktorer samt alle kasuistikker, kommentarer og konferanseinnlegg ble ekskludert. Resultatet av søket ble til sammen 137 artikler. 101 artikler ble ekskludert på bakgrunn av tittel, da det fremkom at de ikke omhandlet modifiserbare risikofaktorer. 36 artikler ble gjennomlest. Ytterligere 25 av disse ble ekskludert fordi de ikke omhandlet modifiserbare risikofaktorer. 11 av de inkluderte artiklene var enten oversiktsartikler eller originalstudier med data om modifiserbare risikofaktorer for frontotemporal demens. I tillegg ble en artikkel fra referanselisten til en av de 11 artiklene inkludert, slik at til sammen 12 artikler ble inkludert (fig 1, tab 1) (13), (15–22).
Tabell 1
Risikofaktorer for frontotemporal demens i inkluderte studier
| Studie | Land | Setting | Utvalg | Hovedfunn | |
|---|---|---|---|---|---|
| Pasient-kontroll-studie | |||||
| De Reuck, 2012 (15) | Frankrike | En hukommelsesklinikk og et sykehus | 22 hjerner fra døde personer diagnostisert med frontotemporal demens | Cerebrovaskulære risikofaktorer og lesjoner var sjeldne hos personer med frontotemporal demens, mens endringer i hvit substans var mer prevalent og hadde større alvorlighetsgrad. | |
| Golimstok, 2014 (16) | Argentina | Sykehus | 100 personer med frontotemporal demens | Diabetes ble funnet som risikofaktor for frontotemporal demens. | |
| Kalkonde, 2012 (17) | USA | Hukommelsesklinikk | 63 pasienter med atferdsvariant av frontotemporal demens | Utvalget hadde større prevalens av traumatisk hjerneskade og lavere prevalens av hjertesykdom og cerebrovaskulær sykdom enn kontrollgruppen. | |
| Torralva, 2015 (18) | USA | Sykehus | 62 pasienter med atferdsvariant av frontotemporal demens og cerebrovaskulær sykdom | Utvalget var eldre ved sykdomsdebut og hadde flere tilfeller av slag og hypertensjon enn kontrollgruppen. | |
| Borroni, 2008 (19) | Italia | Sykehus | 117 pasienter med frontotemporal demens | Utvalget var yngre enn kontrollgruppene med Alzheimers sykdom og progressiv supranukleær parese. | |
| Rosso, 2003 (13) | Nederland | Sykehus | 80 pasienter med sporadisk frontotemporal demens | Utvalget hadde større prevalens av hodetraume og stoffskiftesykdom enn kontrollgruppen. | |
| Miller, 2013 (20) | USA | Akademisk medisinsk senter | 129 pasienter med semantisk variant av primær progressiv afasi | Utvalget og kontrollgruppen med bærere av progranulinmutasjon hadde økt prevalens av enkelte autoimmune sykdommer sammenlignet med kontrollgruppene med kognitivt friske og Alzheimers sykdom. | |
| Deutsch, 2015 (21) | USA | Akademisk medisinsk senter | 1 016 pasienter med frontotemporal demens | Hodetraume med tap av bevissthet var mer vanlig i utvalget enn i kontrollgruppen. | |
| Atkins, (2012) (22) | Australia | Forskningssenter | 62 personer med tidlig Alzheimers sykdom | Det var flere røykere og personer med høyere vekt i utvalget enn i kontrollgruppen med tidlig Alzheimers sykdom. | |
Litteraturgjennomgangen ble utført i henhold til PRIMSA-kriteriene (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (23).
Utdanning
Høy utdanning regnes for å være beskyttende mot Alzheimers sykdom og vaskulær demens (19). Sammenhengen mellom grad av utdanning og frontotemporal demens, progressiv supranukleær parese og kortikobasal degenerasjon har også blitt undersøkt (19). I analysen inkluderte man risikofaktorer som arv, kardiomyopati, hypertensjon, hyperkolesterolomi, diabetes og apolipoprotein og justerte for alder og kjønn. Utvalget besto av 117 pasienter med frontotemporal demens. I kontrollgruppene var det 400 pasienter med Alzheimers sykdom, 55 med primær supranukleær parese og 55 med kortikobasal degenerasjon. Studien viste at personer med frontotemporal demens var i snitt yngre ved sykdomsdebut, hadde høyere utdanning og oftere hadde familiemedlemmer med demens sammenlignet med kontrollgruppene (19).
Kardiovaskulære risikofaktorer
I en annen studie fra 2014 fant man at omtrent 60 % av pasientene med frontotemporal demens var sporadiske tilfeller (16). Studien inkluderte 100 pasienter med frontotemporal demens og en kontrollgruppe på 200 personer. Etter at det ble justert for kjønn, alder, diabetes, hypertensjon, overvekt, dyslipidemi, hypotyreose og osteoporose, fant man signifikant sammenheng mellom frontotemporal demens og diabetes type 2 sammenlignet med kontrollgruppen. Diabetes type 2 ble vist å være en uavhengig risikofaktor for frontotemporal demens (16).
I 2015 fant forskere at det var mer krevende å stille diagnosen frontotemporal demens hos personer som tidligere hadde gjennomgått hjerneslag (18). Pasienter med atferdsvarianten av frontotemporal demens hadde oftere hypertensjon og anamnestiske opplysninger om hjerneslag. Funnene i denne studien tyder på at cerebrovaskulær sykdom ikke bør utelukkes ved atferdsvariantene (18).
I en annen prospektiv studie fant man at personer med tidlig Alzheimers sykdom hadde nesten tre ganger høyere risiko for hypertensjon enn personer med tidlig frontotemporal demens, mens røyking og overvekt var mer vanlig i gruppen med tidlig frontotemporal demens (22). Ved hjelp av 22 hjernebiopsier fant forskere at cerebrovaskulære lesjoner var sjeldnere hos personer med frontotemporal demens sammenlignet med friske kontrollpersoner, men at hvite substansendringer forekom oftere. Disse bør derfor ikke brukes som en prognostisk indikator alene (15).
Hodetraume
Hodetraume var assosiert med økt risiko for frontotemporal demens, med en oddsratio på 3,3 i et utvalg av 80 pasienter med sporadisk frontotemporal demens som ble sammenlignet mot en kontrollgruppe på 124 personer uten kognitiv svikt (13).
I en annen studie ble et utvalg på 63 pasienter med atferdsvariant av frontotemporal demens sammenlignet med en kontrollgruppe på 491 pasienter med annen demenssykdom. Man fant at traumatisk hjerneskade var mer vanlig hos pasienter med frontotemporal demens (17).
En større undersøkelse som inkluderte 1 016 personer med frontotemporal demens og en kontrollgruppe med 2 015 personer uten kognitiv svikt, viste at hodetraume med tap av bevissthet er mer vanlig hos pasienter med frontotemporal demens og kan øke risikoen for tilstanden (21).
Autoimmun sykdom
En studie har vist at semantisk variant av primær progressiv afasi og bærere av proteinet progranulin er forbundet med økt prevalens av spesifikke autoimmune sykdommer sammenlignet med friske kontrollpersoner og kontrollpersoner med Alzheimers sykdom (20).
Diskusjon
Vår litteraturoversikt viser at det er få studier der man har undersøkt modifiserbare risikofaktorer for frontotemporal demens (4, 5). Det er viktig å ta i betraktning at tidlige symptomer på frontotemporal demens kan være impulsiv og utagerende atferd som medfører blant annet hyperoralitet med økt inntak av spesielt karbohydratrik mat eller økt bruk av alkohol og røyk (1, 3). Man vet lite om lengden på prodromalfasen ved frontotemporal demens, men studier viser at det kan ta opptil fem år fra utredning starter til diagnose blir satt (8).
Studien som viste at pasienter med frontotemporal demens var yngre og hadde høyere utdanning enn pasienter med Alzheimers sykdom, brukte personer med andre demenssykdommer som kontrollgrupper. Dette kan gi seleksjonsskjevheter på grunn av ulik alder ved sykdomsdebut (19). Det må også tas høyde for en annen skjevhet: Høyere utdanning er mer vanlig blant yngre personer enn blant eldre, og frontotemporal demens rammer ofte yngre personer.
Av kardiovaskulære risikofaktorer er det funnet signifikant sammenheng mellom frontotemporal demens og diabetes type 2 i én studie (16), og en signifikant sammenheng mellom røyking, overvekt og frontotemporal demens i en annen (22). I pasient-kontroll-studier kan overvekt og røyking bli oppfattet som modifiserbare risikofaktorer for frontotemporal demens, men kan også være del av prodromalfasen.
For hypertensjon som risikofaktor er det motstridende funn i to studier: Kalkonde og medarbeidere fant at prevalensen av hypertensjon hos pasienter med frontotemporal demens og andre demenstyper er ganske lik (17), mens Atkins og medarbeidere, som inkluderte et utvalg av personer med tidlig fase av frontotemporal demens og en kontrollgruppe med tidlig fase av Alzheimers sykdom, fant at hypertensjon er mer vanlig ved Alzheimers sykdom (22). En årsak til de motstridende funnene kan være at den ene studien brukte et yngre utvalg og en yngre kontrollgruppe.
Tre studier viser at hodetraumer gir økt risiko for å utvikle frontotemporal demens. En av disse studiene har et betydelig større utvalg enn alle de andre studiene vi har funnet, med 1 016 personer med frontotemporal demens (21). Hodetraume er den mest undersøkte risikofaktoren, men to av studiene har små utvalg og alle de tre studiene har ulike definisjoner på hodetraume. Én studie har funnet en sammenheng mellom autoimmun sykdom og semantisk variant av primær progressiv afasi (20). Denne studien har ingen kontrollvariabler på andre sykdommer eller livstilsvariabler, noe som anses som en svakhet. Det er uklart om det er noen sammenheng mellom systemisk autoimmun sykdom og frontotemporal demens.
Konklusjon
Litteraturen indikerte sammenhenger mellom diabetes, hodetraume, autoimmun sykdom og frontotemporal demens, men kunnskapsgrunnlaget er per i dag for snevert til å kunne trekke slutninger. Det finnes ikke tilstrekkelig kunnskap for å fremme anbefalinger om konkrete livsstilsendringer for å forebygge frontotemporal demens på befolkningsnivå.
En av forfatterne er redaktør i Tidsskriftet. Manuskriptet er derfor behandlet eksternt av setteredaktør Jan Frich.
Hovedbudskap
Vi fant ingen studier som kunne vise til behandling for å bremse eller hindre utviklingen av frontotemporal demens
Hodetraume var den største risikofaktoren for frontotemporal demens blant de som ble undersøkt i denne studien
Siden ingen behandling eksisterer per i dag, er det stort behov for mer forskning på hvordan man kan forebygge frontotemporal demens
- 1.
Bang J, Spina S, Miller BL. Frontotemporal dementia. Lancet 2015; 386: 1672 - 82. [PubMed][CrossRef]
- 2.
Johnson JK, Diehl J, Mendez MF et al. Frontotemporal lobar degeneration: demographic characteristics of 353 patients. Arch Neurol 2005; 62: 925 - 30. [PubMed][CrossRef]
- 3.
Bott NT, Radke A, Stephens ML et al. Frontotemporal dementia: diagnosis, deficits and management. Neurodegener Dis Manag 2014; 4: 439 - 54. [PubMed][CrossRef]
- 4.
Rosness TA, Engedal K, Chemali Z. Frontotemporal dementia: an updated clinician's guide. J Geriatr Psychiatry Neurol 2016; 29: 271 - 80. [PubMed][CrossRef]
- 5.
Onyike CU, Diehl-Schmid J. The epidemiology of frontotemporal dementia. Int Rev Psychiatry 2013; 25: 130 - 7. [PubMed][CrossRef]
- 6.
Cerami C, Scarpini E, Cappa SF et al. Frontotemporal lobar degeneration: current knowledge and future challenges. J Neurol 2012; 259: 2278 - 86. [PubMed][CrossRef]
- 7.
Ratnavalli E, Brayne C, Dawson K et al. The prevalence of frontotemporal dementia. Neurology 2002; 58: 1615 - 21. [PubMed][CrossRef]
- 8.
Rosness TA, Haugen PK, Passant U et al. Frontotemporal dementia: a clinically complex diagnosis. Int J Geriatr Psychiatry 2008; 23: 837 - 42. [PubMed][CrossRef]
- 9.
Manoochehri M, Huey ED. Diagnosis and management of behavioral issues in frontotemporal dementia. Curr Neurol Neurosci Rep 2012; 12: 528 - 36. [PubMed][CrossRef]
- 10.
Mendez MF. Frontotemporal dementia: therapeutic interventions. Front Neurol Neurosci 2009; 24: 168 - 78. [PubMed][CrossRef]
- 11.
Patterson C, Feightner J, Garcia A et al. General risk factors for dementia: a systematic evidence review. Alzheimers Dement 2007; 3: 341 - 7. [PubMed][CrossRef]
- 12.
Karageorgiou E, Miller BL. Frontotemporal lobar degeneration: a clinical approach. Semin Neurol 2014; 34: 189 - 201. [PubMed][CrossRef]
- 13.
Rosso SM, Landweer EJ, Houterman M et al. Medical and environmental risk factors for sporadic frontotemporal dementia: a retrospective case-control study. J Neurol Neurosurg Psychiatry 2003; 74: 1574 - 6. [PubMed][CrossRef]
- 14.
Skjerve A, Brenne L. Frontotemporal demens – kjennetegn, diagnostikk og behandlingstiltak. Tidsskr Nor Psykolog 2002; 39: 1 - 8.
- 15.
De Reuck JL, Deramecourt V, Cordonnier C et al. Cerebrovascular lesions in patients with frontotemporal lobar degeneration: a neuropathological study. Neurodegener Dis 2012; 9: 170 - 5. [PubMed][CrossRef]
- 16.
Golimstok A, Cámpora N, Rojas JI et al. Cardiovascular risk factors and frontotemporal dementia: a case-control study. Transl Neurodegener 2014; 3: 13. [PubMed][CrossRef]
- 17.
Kalkonde YV, Jawaid A, Qureshi SU et al. Medical and environmental risk factors associated with frontotemporal dementia: a case-control study in a veteran population. Alzheimers Dement 2012; 8: 204 - 10. [PubMed][CrossRef]
- 18.
Torralva T, Sposato LA, Riccio PM et al. Role of brain infarcts in behavioral variant frontotemporal dementia: Clinicopathological characterization in the National Alzheimer's Coordinating Center database. Neurobiol Aging 2015; 36: 2861 - 8. [PubMed][CrossRef]
- 19.
Borroni B, Alberici A, Agosti C et al. Education plays a different role in Frontotemporal Dementia and Alzheimer's disease. Int J Geriatr Psychiatry 2008; 23: 796 - 800. [PubMed][CrossRef]
- 20.
Miller ZA, Rankin KP, Graff-Radford NR et al. TDP-43 frontotemporal lobar degeneration and autoimmune disease. J Neurol Neurosurg Psychiatry 2013; 84: 956 - 62. [PubMed][CrossRef]
- 21.
Deutsch MB, Mendez MF, Teng E. Interactions between traumatic brain injury and frontotemporal degeneration. Dement Geriatr Cogn Disord 2015; 39: 143 - 53. [PubMed][CrossRef]
- 22.
Atkins ER, Bulsara MK, Panegyres PK. Cerebrovascular risk factors in early-onset dementia. J Neurol Neurosurg Psychiatry 2012; 83: 666 - 7. [PubMed][CrossRef]
- 23.
PRISMA Group. Reprint–preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Phys Ther 2009; 89: 873 - 80. [PubMed]