Background.
Colorectal cancer is a genetic disease for which the adenoma-carcinoma-sequence has served as a teaching model. This article presents an update on carcinogenesis and classification, according to the increased understanding of precursors and the improved insight into molecular biological mechanisms.
Material and methods.
Literature from 1.1 2002 to 15.7 2007 was reviewed from PubMed by using the search words «colorectal cancer» matched with MeSH-terms «genetic instability», «epigenetic», «molecular classification», «crypt», «apoptosis», «proliferation» and «carcinogenesis». Focus is based on recent reviews (including systematic reviews), and selected original papers.
Results and interpretation.
Colorectal cancer develops in the stem cells of the crypts through deregulated molecular mechanisms such as the Wnt-pathway, which lead to increased proliferation, lack of differentiation and loss of apoptosis. Precursors, such as the aberrant crypt foci, have potential as early biomarkers, but consensus lacks for their clinical utility. Assumed «innocent» polyps, such as serrated adenomas, appear to play a larger role than previously expected, mainly through epigenetics (CpG Island Methylator Phenotype; CIMP) and microsatellite instability (MSI). Three main pathways occur in the colorectal carcinogenesis (chromosomal instability [CIN] , MSI and CIMP), of which CIN represents the major part. These pathways have distinct clinical, pathological, and genetic characteristics, which can be used for molecular classification for improved diagnostics, prognosis and treatment.
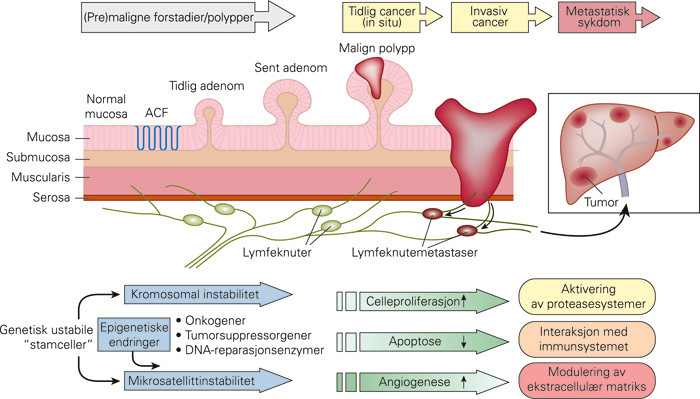
Kreft i tykktarmen kan være arvelig, komme som en senfølge av inflammatorisk tarmsykdom eller oppstå sporadisk. «Arv» og «miljø» spiller således en noe ulik rolle for kreftutviklingen hos den enkelte. En fellesnevner er likevel at sykdommen er genetisk betinget. «Adenom-karsinom-sekvensen» har de siste tiårene fungert som modell for trinnvis kreftutvikling i tykktarmen. Imidlertid har nyere kunnskap gjort at synet på kolorektal kreft som en homogen sykdom er forandret. Polyppen som nødvendig forstadium i utviklingstrinnene står ikke like sterkt, det synes å foreligge flere genetiske, molekylære og morfologisk egenartede veier til kreft (1).
Karsinogenesen fra normal mucosa til metastatisk kolorektal kreft (fig 1) er i økende grad forstått som en multidimensjonal interaksjon mellom genetiske endringer, slimhinnens epitelceller og de omliggende faktorene i ekstracellulære matriks, inkludert immunsystemet, proteasesystemer og bindevevsceller (2). I denne artikkelen tar jeg opp noen av de nyere sentrale dogmene relatert til den tidlige utviklingen av kolorektal kreft, hvordan denne kunnskapen nå gradvis endrer den molekylærbiologiske klassifiseringen og gir muligheter for bedre diagnostikk, mer korrekt prognose og bedre behandling.
Materiale og metode
Artikkelen er basert på litteratursøk i PubMed med hovedvekt på artikler publisert de siste fem år (1.1. 2002 – 15.7. 2007). Søkeordet «colorectal cancer» ble kombinert med termene «genetic instability», «epigenetic», «molecular classification», «crypt», «apoptosis», «proliferation» og «carcinogenesis». Det var flere hundre treff på hvert søk. Artikler ble derfor tatt med på bakgrunn av ønsket om å inkludere hele, eller de fleste deler av, kreftutviklingen i tykktarmen relatert til humant materiale, fortrinnsvis der funnene var basert på en klinisk tilnærming. Rene eksperimentelle basalvitenskapelige studier basert på cellelinjer og/eller dyremodeller ble i hovedsak ekskludert. Det ble søkt etter oversiktsartikler og systematiske oversikter fra de siste tre år (1.7. 2004 – 15.7. 2007). Artikkelens innhold er i hovedsak basert på sentrale oversiktsarbeider og identifiserte systematiske litteraturoversikter (3–8). Enkelte nyere originalarbeider er inkludert for utfyllende informasjon.
Adenom-karsinom-sekvensen og kreftforstadier
Adenomatøse polypper regnes som obligate forstadier til kreft i tykktarmen. Polypper er dermed naturlige ende- og målpunkter for diagnostikk, behandling og forebygging av tykktarmskreft. Polypper er synlige og tilgjengelige for behandling med endoskopisk teknikker, noe som er klinisk fordelaktig.
Hyperplastiske polypper er regnet som ufarlige og er ikke tatt med i den tradisjonelle adenom-karsinom-sekvensen. Enkelte hyperplastiske polypper har et såkalt sagtakket vekstmønster (serrated adenomas), noe som er assosiert med økt kreftrisiko (9). Et takket vekstmønster gjenfinnes også i noen adenomer og karsinomer, og med økt molekylærgenetisk innsikt har man funnet at disse tilhører en «sagtakket signalvei» (serrated pathway), der epigenetiske endringer kan påvises (1). Utviklingen gjennom adenom-karsinom-sekvensen er således en forenklet homogen modell for en betydelig mer heterogen utvikling karakterisert av distinkte (men også overlappende) genetiske, epigenetiske og morfologiske egenskaper. Disse genetiske forskjellene synes å være mest betydningsfulle for initiering og utvikling av forstadiene til kreft, mens et større spekter av overlappende genetiske egenskaper og molekylære interaksjoner forekommer senere i karsinogenesen.
Fra krypt til kreft
Tidlige (pre)maligne endringer antas å oppstå i tykktarmslimhinnens krypter. I såkalte aberrante kryptfokuser (aberrant crypt foci, ACF) finnes morfologiske og genetiske endringer som skiller disse kryptene fra normal tykktarmslimhinne. I dem foreligger det allerede flere av de genetiske mutasjonene som kan gjenfinnes i adenomer og kreftsvulster (10) –(12). Aberrantkryptfokuser synes således å være et sannsynlig forstadium til både adenomer og kreft, og de antas å kunne progrediere direkte til kreft uten å gå via adenomstadiet (11). Særlig i dyremodeller brukes aberrrantkryptfokuser som endepunkt ved studier omkring karsinogenese og eksperimentelle behandlingsmåter (11). Selv om de har et klinisk potensial som biomarkør for (tidlig) kolorektal kreft, bl.a. støttet av funn fra enkelte epidemiologiske studier (10, 12), er definisjoner for identifisering med høyoppløselig kromoendoskopi av disse fortsatt sprikende og mangler konsensus (12). Det er således fortsatt knyttet usikkerhet til den kliniske betydningen av aberrante kryptfokuser.
Stamceller og signalveier
Kreft utgår fra en enkelt «stamcelle» som innehar, eller som har fått, genetiske endringer (13). Tykktarmens slimhinne regenereres hyppig, med en antatt omsetningstid på 4 – 7 dager for epitelceller i colonslimhinnen (fig 2). Den høye proliferasjonsraten gir økt risiko for mutasjoner, ettersom celledeling per se kan føre til DNA-endringer. I tillegg eksponeres cellene fra tarmlumens innhold, der bl.a. metabolitter, toksiske stoffer og bakterieflora kan påvirke epitelcellene. Flere molekylære mekanismer er derfor involvert i kontrollen av proliferasjon og differensiering i kryptene i tarmtraktens embryogenetiske utvikling og livslange homøostase (14, 15).
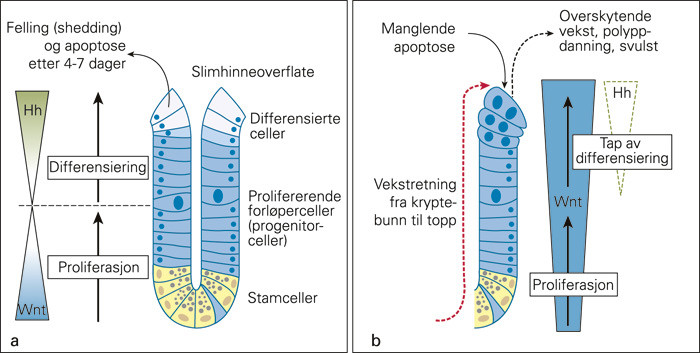
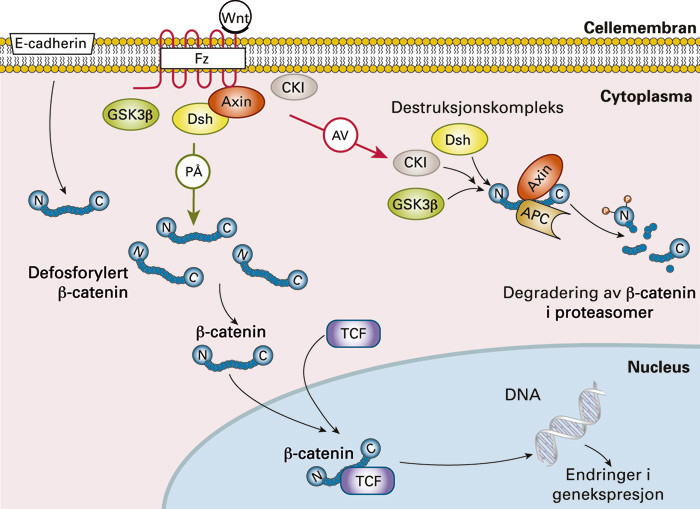
Stamceller i colonkryptene regnes for å være noe av nøkkelen bak muligheten for fremtidig forebygging og målrettet behandling av kolorektal kreft, men disse cellene er ennå ikke identifisert med spesifikke markører (13). Flere signalveier som er viktige for normal utvikling påvises imidlertid å være feilregulert i kreft (fig 2). Blant de viktigste av disse signalveiene er den såkalte Wnt-signalveien («Wnt» kommer av «wingless», som beskriver mutasjonseffekten ved denne signalveien funnet i fruktfluen Drosophila), der β-catenin er en av nøkkelspillerne. Wnt-signalveien er ofte feilregulert i kolorektal kreft, det fører til kontinuerlig proliferasjon og manglende celledifferensiering (14) – (16). Wnt-signalveien viser hvordan forskjellige proteiner kan interagere på veien fra cellemembran til cellekjerne (fig 3). APC-genet er f.eks. mutert hos pasienter med familiær adenomatøs polypose (FAP), noe som gir en mangel på dette proteinet. APC-proteinet inngår normalt sett i et proteinkompleks (destrueringskompleks) sammen med Axin og andre proteiner for å hindre translokasjon og kobling av β-catenin til T-cellefaktor (TCF) og dermed signal om genekspresjon (f.eks. proliferasjonsfaktorer) i cellens kjerne (fig 3). Når APC mangler, vil det føre til en kontinuerlig innstrømming av β-catenin i cellekjernen, vedvarende proliferasjon og manglende differensering (fig 2, fig 3). Selv om Wnt-signalveien er feilregulert i alle tilfeller av kolorektal kreft, kan genetiske og epigenetiske endringer i ulike komponenter (APC, TCF, Axin, WISP3 og CTNNB1, som koder for β-catenin) gjenfinnes i over 90 % av svulstene (17).
Proliferasjon og apoptose
Nettoeffekten gjennom kreftutviklingen måles i balansen mellom regulering av celleproliferasjon og apoptose (programmert celledød). I den vanlige progredieringsmodellen for kolorektal kreft antas apoptosemekanismer å nedreguleres i adenom-karsinom-sekvensen (fig 1). Dette kan skje på flere forskjellige måter gjennom et intrinsisk og ekstrinsisk apoptosesystem, omtalt i detalj annet sted (18).
I tillegg til manglende differensiering og kromosomal instabilitet vil mutert APC oppregulere proteinet survivin, som hemmer apoptosen, samtidig som p21 nedreguleres og gir økt proliferasjon (18). På den måten dannes forsterkende kaskadeeffekter ved enkelte molekylære hendelser i cellene. Oppregulering av proteiner som regulerer cellesyklus og apoptosekontroll synes å kunne indikere langtidsrisikoen for tykktarmskreft hos pasienter med adenomer (19). For TP53, som fungerer som vaktpost for skadet DNA, synes det å foreligge økt relativ risiko på rundt 1,3 for kreftdød ved patologisk akkumulert (målt ved immunhistokjemi) eller mutert (sekvensanalyse) protein (7). I en systematisk oversikt er det fremholdt at andelen celler som går i apoptose synes å øke med tumorprogredieringen, og at bruk av apoptotisk indeks ikke synes å kunne forsvares som effektmål for kjemoterapi (5).
Kontroll av apoptosemekansimer anses å ha potensial som målrettet terapi for kolorektal kreft og adenomer, f.eks. med COX-2-hemmere. Også når det gjelder BCL2-familien, survivin og andre apoptosehemmende proteiner er terapi under utvikling (18, 20).
Genetisk instabilitet
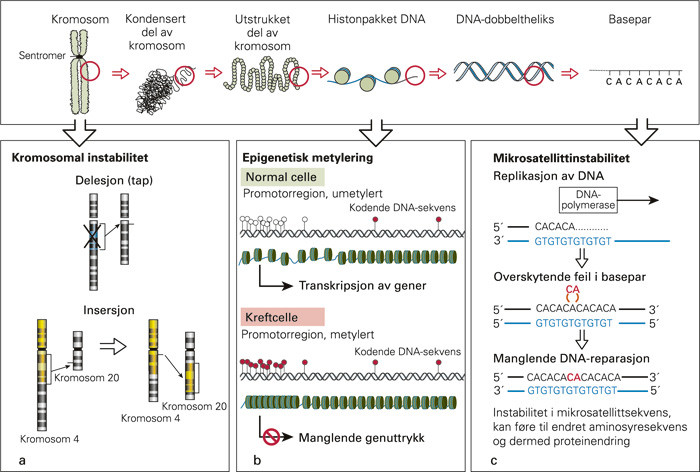
Kreft oppstår gjennom genetiske forandringer som fører til en rekke fenotypiske endringer i cellens egenskaper (tab 2) (21). Genetiske endringer, og dermed instabilitet, i det humane genomet kan oppstå i alle deler av den strukturelle oppbygningen – alt fra store endringer på kromosomene til mindre endringer i enkelte basepar (fig 4). Der hvor endringene inntrer i en region som koder for et gen, kan endringene føre til at genproduktet (proteinet) endres – ved at det blir forhøyet produksjon, tapt produksjon, feilproduksjon eller på andre måter feilregulering i styringen av cellens signaler og omgivelser. Genomisk instabilitet relatert til kolorektal kreft deles gjerne inn i kromosomal instabilitet (chromosomal instability, CIN) og mikrosatellittinstabilitet (microsatellite instability, MSI), og oppstår også gjennom epigenetisk metylering av CpG-øyer (CpG island methylation phenotype, CIMP).
Tabell 1
Molekylær klassifisering av kolorektal kreft (CIN = kromosomal instabilitet, MSI = mikrosatellittinstabilitet (høy- eller lavfrekvent), CIMP = CpG island methylator phenotype)
| Klasse | Type | CIN | MSI | CIMP | Assosiert genetikk | Estimert forekomst (%) |
| 1 | Sporadisk | – | ++ | ++ | MSI-H; metylert MLH1; BRAF | Ca. 12 |
| 2 | Sporadisk | – | + | ++ | MSI-L, BRAF | Ca. 8 |
| 3 | Sporadisk | ++ | –/+ | + | MSI-L og CIMP-L; MGMT, KRAS | Ca. 20 |
| 4 | Sporadisk (samt arvelig familiær adenomatøs polypose) | ++ | – | – | APC-mutasjon, KRAS, TP53 | Ca. 55 –60 |
| 5 | Hereditær ikke-polypøs coloncancer | – | ++ | – | Mutert MLH1, MSH2, MSH6 o.a. | 3 –4 % |
| [i] | ||||||
[i] – = stabilitet
+ = lavfrekvent instabilitet
++ = høyfrekvent instabilitet
Tabell 2
Kreftcellens egenskaper relatert til kolorektal kreft
| Egenskap hos kreftcelle | Kolorektal kreft, eksempler |
| Selvforsyning av vekstsignaler | Muterte onkogener som KRAS, EGFR |
| Insensitivitet for veksthemmere | Mutert tumorsuppressorgen som APC, nedregulert TGF-β |
| Unnviker programmert celledød (apoptose) | Oppregulert BCL2, mutert TP53, oppregulert survivin, endringer i FasL- og caspasesystem |
| Nydanning av kar (angiogenese) | Vaskulær endotelial vekstfaktor (VEGF), platelet-derived growth factor receptor (PDGFR) |
| Ubegrenset evne til celledeling | Danning av telomerase (hTERT) |
| Evne til å invadere og metastasere | Matriksmetalloproteinaser, andre proteasesystemer o.l. |
Kromosomal instabilitet
Kromosomal instabilitet kjennetegnes ved endret kromosomantall utover de 46 kromosomene i hver somatisk celle. Aneuploide celler har et abnormt genetisk innhold, et karakteristisk og hyppig kjennetegn ved solide svulster, og forekommer ofte i kolorektal kreft (22). Årsaken til instabiliteten er flerfoldig. Mutasjon i APC-genet er assosiert med CIN-signalveien og opptrer tidlig i karsinogenesen – APC-genet ble funnet på den lange armen til kromosom 5 og er knyttet til den arvelige kreftformen familiær adenomatøs polypose (23, 24).
Faktorer som kontrollerer kromosomenes sentromerer og deltar i mitosefasens sjekkpunkter under celledeling forårsaker aneuploiditet og kromosomal instabilitet. Feilregulering av disse kontrollmekanismene fører i sin tur til endringer og ubalanse i kromosomstruktur og -innhold (fig 4a), noe som igjen endrer ekspresjonen av genregioner og dermed proteinuttrykk. Eksempler på noen av de proteinene som spiller en regulerende rolle i spindelcelleapparatet og ved mitosedeling er Aurora A, survivin, MAD2, BUB1, BUBR1 og forskjellige sykliner (19, 25, 26).
Kromosomal instabilitet kan evalueres med ploiditetsanalyse, der aneuploiditet er kjennetegnet. Mer spesifikke kromosomanalyser kan gjøres med f.eks. CGH-analyse (comparativ genomic hybridization) for å finne regioner på kromosomer som er overuttrykt eller underuttrykt. En lang rekke kromosomale endringer er undersøkt og påvist i kolorektal kreft (f.eks. tap av 18q og 20q), uten at noen av disse eller ploiditetsanalyse for øvrig har fått innpass som standard prognostisk markør før kreft (6, 27) – (30). Alleltap på kromosom 18q og tap av DCC-proteinet gir dårligere totaloverlevelse, med en hasardratio på rundt 2,0 (95 % KI 1,5 – 2,7), ut fra en metaanalyse av publiserte studier på disse markørene, men med variasjon mellom metoder (genotyping mot immunhistokjemi), påvist heterogenitet i materialene og sannsynlig publiseringsskjevhet (6). Å legge vekt på kromosomal instabilitet synes således å være mest nyttig relatert til hvordan og hvorfor den oppstår og bidrar til karsinogenesen, der denne kunnskapen forhåpentligvis kan knyttes til nye preventive og terapeutiske angrepspunkter (22, 25, 26).
Mikrosatellittinstabilitet
Mikrosatellitter er repeterende sekvenser spredt utover hele genomet. På grunn av denne gjentakende sekvens er de spesielt utsatt for feil ved DNA-replikasjon (fig4c). Ved slike feil vil normalt sett cellens vaktmestre, DNA-reparasjonsenzymene (DNA mismatch repair enzymes, MMR), fikse disse enkle feilene før cellene går videre i celledelingssyklusen. Muterte reparasjonsenzymer (f.eks. MLH1, MSH2 og MSH6), som er årsaken til kreft hos pasienter med hereditær ikke-polypøs coloncancer (HNPCC), fører til at disse feilene vedvarer cellesyklus etter cellesyklus og kan dermed føre til endret gensekvens i regioner som koder for enkelte proteiner (31). Mikrosatellittinstabilitet kan endre den genetiske leserammen i aminosyresekvensen (frameshift mutation) og dermed proteinuttrykket – slike endringer finnes gjerne i proteiner som β-catenin, BAX og TGF-βRII (transforming growth factor beta receptor II). Muterte MMR-proteiner forårsaker hereditær ikke-polypøs coloncancer, og de kan testes med immunhistokjemisk undersøkelse eller genotypisk med spesifikke mutasjonsanalyser (32).
Mikrosatellittinstabilitet foretrekkes påvist med polymerasekjedereaksjon for et større antall MSI-markører, der instabilitet i ≥ 40 % av markørene indikerer høyfrekvent mikrosatellittinstabilitet (MSI-H), 20 – 40 % indikerer lavfrekvent (MSI-L) og < 20 % instabile markører indikerer mikrosatellittstabilitet (31, 32). Grunnet varierende bruk av antall og type markører, bl.a. ulikheter i dinukleotide og mononukleotide markører (31, 32), er det vanskelig å sammenlikne resultater fra forskjellige kliniske studier.
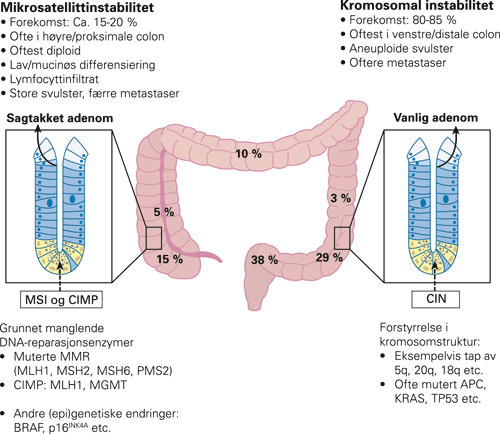
Mikrosatellittinstabilitet påvises i 15 – 20 % av tilfellene av sporadisk kolorektal kreft. Hos disse pasientene er dette assosiert med egenartede kliniske og morfologiske funn (31), som gjengitt i figur 5. MSI-positiv kolorektal kreft innebærer bedre prognose enn CIN-signalveikreft, det synes å bli bekreftet i en metaanalyse (3). Angivelig skal pasienter med MSI-positiv kreft ikke ha samme effekt av adjuvant cellegiftbehandling (5-FU basert), men dette er ikke påvist med statistisk signifikant forskjell i samme metaanalyse (3). Sprikende resultater i større studier fra de siste årene tyder på at det vil være behov for standardisering av metodevalg og studiedesign også ved denne problemstillingen (33) – (35).
Epigenetikk
Epigenetiske endringer fører ikke til forandringer i selve DNA-strengen, slik som ved genmutasjoner, men de endrer tilgjengelighet gjennom strukturelle forandringer i den «epigenetiske kode» – f.eks. ved endringer i histonene som pakker inn DNA-strengen, ved over- og/eller undermetylering av DNA-områder (fig 4B) eller gjennom RNA-interferens (36, 37). Avvikende DNA-metylering av såkalte CpG-øyer forekommer ofte i kolorektal kreft. CpG-øyer er områder som innholder rikelig med cystein- og guaninbaser og ofte ligger nær geners promotorregioner. Når disse områdene blir metylert, fører det til at genene blir «stumme» og proteinene dermed ikke uttrykkes (fig 4b).
I en undergruppe av kolorektalkrefttyper er det usedvanlig høy forekomst av metylerte CpG-øyer – «CpG island methylator phenotype» (CIMP). CIMP-signalveien kalles nå gjerne for «den tredje signalveien» i kolorektal kreft – i tillegg til kromosomal instabilitet og mikrosatellittinstabilitet (38). I tilfeller av sporadisk coloncancer er CIMP nesten utelukkende assosiert med metylering av MLH1 og har en veldig høy forekomst av BRAF-mutasjoner (39). Denne fenotypen synes å være inverst korrelert med kromosomal instabilitet, slik at CIMP og mikrosatellittinstabilitet står som motsetning til CIN-signalveien i kolorektal kreft (31, 36, 40). Funn tyder på at promotormetylering skjer tidlig i karsinogenesen (41), muligens allerede i premaligne stamceller og progenitorceller i colonkryptene (37, 42). Metylering er funnet i de fleste av genene i Wnt-signalveien, i tillegg også hyppig i DNA-reparasjonsenzymer som MLH1 og MGMT og i tumorsupressorgener som p16INK4A. Bedre viten på dette feltet vil kunne åpne for nye muligheter innen diagnostikk, prognosevurdering og terapeutiske markører. Eksempelvis vil farmakologisk demetylering kunne gjenåpne for transkripsjon av stumme gener og dermed f.eks. gjenaktivere tumorsuppressorgener.
Molekylærbiologisk klassifisering
Basert på de til nå kjente hovedsignalveiene kromosomal instabilitet, mikrosatellittinstabilitet og CIMP, korrelert med de morfologiske funnene, er det oppstått endret syn på klassifiseringen av kolorektal neoplasi (1, 31, 36, 38). En detaljert gjengivelse av morfologiske, kliniske og molekylære grupperinger basert på disse hovedsignalveiene er presentert av Jass (1), og en forenklet oppsummering er gjengitt i tabell 1. Det er en generell forståelse at det er tre hovedgrupper ut fra hvilken type «instabilitet» som dominerer – her vil implementering og eventuell videre stratifisering kunne gjøres, bl.a. med funn fra genekspresjonsstudier, for å finne pasientgrupper med «gode» og «dårlige» molekylærbiologiske signaturer (43, 44).
Den store gruppen pasienter utgjøres fortsatt av mennesker med kreft oppstått gjennom kromosomal instabilitet som i hovedsak følger den klassiske adenom-karsinom-sekvensen (fig 1, fig 5). Pasienter med familiær adenomatøs polypose hører også til i denne gruppen, mens de med hereditær ikke-polypøs coloncancer hører til gruppen med mikrosatellittinstabilitet, basert på at de har muterte DNA-reparasjonsenzymer som forårsaker instabiliteten. Det er likevel et poeng at sporadisk mikrosattellittinstabilitet og hereditær ikke-polypøs coloncancer er biologisk forskjellige, siden det ikke finnes BRAF-mutasjoner hos pasienter med hereditær ikke-polypøs coloncancer, men ofte i sporadisk mikrosatellittinstabilitet (1, 39). Om denne typen molekylærbiologisk klassifisering vil ta over for nåværende TNM-klassifisering ved kolorektal kreft gjenstår å se, men det er nærliggende å anta at med verifisering av disse signalveienes gyldighet, validering av kliniske, prognostiske og prediktive konsekvenser samt standardisering og tilgjengelighet av testmetode vil det kunne være et mer treffsikkert og kostnadseffektivt stratifiseringsverktøy.
Prognostiske og prediktive markører
Økt forståelse av kolorektalkreftkarsinogenesen og utviklingen av molekylærbiologiske teknikker har gitt et økende panorama av tumormarkører. Systematiske oversikter over prognostiske og prediktive markører innen kolorektal kreft konkluderer med at det foreligger varierende grad av heterogenitet i pasientmaterialet og sprik i metodevalg studiene imellom (3, 4, 6) – (8), noe som gjør konklusjonsgrunnlaget usikkert.
Ved stadig mer standardiserte og tilgjengelige molekylærbiologiske verktøy samt forståelsen av genetisk instabilitet i kolorektal kreft relatert til genese, morfologi og klinisk praksis kan forhåpentligvis resultater av mer ensartet kvalitet sammenliknes.
I internasjonale retningslinjer er det kun måling av karsinoembryonalt antigen (CEA) i blodserum som anbefales som standard preoperativ evaluering og som postoperativ oppfølging (45). Treffsikkerheten for å oppdage residiv etter kirurgi er ikke optimal (46), og markører med bedre risikostratifisering og økt diagnostisk, prognostisk og prediktiv treffsikkerhet trengs. En fortsatt evaluering av potensielle molekylærbiologiske markører ved bruk av moderne teknikker, standardiserte prosedyrer og klinisk relatert pasientmateriale er nødvendig.
Oppgitte interessekonflikter: Ingen
Tabell
| Hovedbudskap |
|
- 1.
Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology 2007; 50: 113–30.
- 2.
Søreide K, Janssen EA, Kørner H et al. Trypsin in colorectal cancer: molecular biological mechanisms of proliferation, invasion, and metastasis. J Pathol 2006; 209: 147 – 56.
- 3.
Popat S, Hubner R, Houlston RS. Systematic review of microsatellite instability and colorectal cancer prognosis. J Clin Oncol 2005; 23: 609 –18.
- 4.
Popat S, Matakidou A, Houlston RS. Thymidylate synthase expression and prognosis in colorectal cancer: a systematic review and meta-analysis. J Clin Oncol 2004; 22: 529 – 36.
- 5.
Koornstra JJ, de Jong S, Hollema H et al. Changes in apoptosis during the development of colorectal cancer: a systematic review of the literature. Crit Rev Oncol Hematol 2003; 45: 37 – 53.
- 6.
Popat S, Houlston RS. A systematic review and meta-analysis of the relationship between chromosome 18q genotype, DCC status and colorectal cancer prognosis. Eur J Cancer 2005; 41: 2060 – 70.
- 7.
Munro AJ, Lain S, Lane DP. P53 abnormalities and outcomes in colorectal cancer: a systematic review. Br J Cancer 2005; 92: 434 – 44.
- 8.
Anwar S, Frayling IM, Scott NA et al. Systematic review of genetic influences on the prognosis of colorectal cancer. Br J Surg 2004; 91: 1275 – 91.
- 9.
Fenoglio-Preiser CM. When is a hyperplastic polyp not a hyperplastic polyp? Am J Surg Pathol 1999; 23: 1001 – 3.
- 10.
Takayama T, Katsuki S, Takahashi Y et al. Aberrant crypt foci of the colon as precursors of adenoma and cancer. N Engl J Med 1998; 339: 1277 – 84.
- 11.
Alrawi SJ, Schiff M, Carroll RE et al. Aberrant crypt foci. Anticancer Res 2006; 26: 107 – 19.
- 12.
Gupta AK, Pretlow TP, Schoen RE. Aberrant crypt foci: what we know and what we need to know. Clin Gastroenterol Hepatol 2007; 5: 526 – 33.
- 13.
McDonald SA, Preston SL, Lovell MJ et al. Mechanisms of disease: from stem cells to colorectal cancer. Nat Clin Pract Gastroenterol Hepatol 2006; 3: 267 – 74.
- 14.
Radtke F, Clevers H. Self-renewal and cancer of the gut: two sides of a coin. Science 2005; 307: 1904 – 9.
- 15.
van den Brink GR, Hardwick JC. Hedgehog Wnteraction in colorectal cancer. Gut 2006; 55: 912 – 4.
- 16.
Castellone MD, Teramoto H, Williams BO et al. Prostaglandin E2 promotes colon cancer cell growth through a Gs-axin-beta-catenin signaling axis. Science 2005; 310: 1504 – 10.
- 17.
Thorstensen L, Lind GE, Løvig T et al. Genetic and epigenetic changes of components affecting the WNT pathway in colorectal carcinomas stratified by microsatellite instability. Neoplasia 2005; 7: 99 – 108.
- 18.
Watson AJ. Apoptosis and colorectal cancer. Gut 2004; 53: 1701 – 9.
- 19.
Søreide K, Buter TC, Janssen E et al. Cell-cycle and apoptosis regulators (p16INK4A, p21CIP1, β-catenin, survivin, and hTERT) and morphometry-defined MPECs predict metachronous cancer development in colorectal adenoma patients. Cell Oncol 2007; 29: 301 – 13.
- 20.
Altieri DC. Targeted therapy by disabling crossroad signaling networks: the survivin paradigm. Mol Cancer Ther 2006; 5: 478 – 82.
- 21.
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57– 70.
- 22.
Rajagopalan H, Nowak MA, Vogelstein B et al. The significance of unstable chromosomes in colorectal cancer. Nat Rev Cancer 2003; 3: 695 –701.
- 23.
Powell SM, Zilz N, Beazer-Barclay Y et al. APC mutations occur early during colorectal tumorigenesis. Nature 1992; 359: 235 – 7.
- 24.
Kinzler KW, Nilbert MC, Vogelstein B et al. Identification of a gene located at chromosome 5q21 that is mutated in colorectal cancers. Science 1991; 251: 1366 – 70.
- 25.
Gerlach U, Kayser G, Walch A et al. Centrosome-, chromosomal-passenger- and cell-cycle-associated mRNAs are differentially regulated in the development of sporadic colorectal cancer. J Pathol 2006; 208: 462– 72.
- 26.
Kops GJ, Weaver BA, Cleveland DW. On the road to cancer: aneuploidy and the mitotic checkpoint. Nat Rev Cancer 2005; 5: 773 – 85.
- 27.
De Angelis PM, Stokke T, Beigi M et al. Chromosomal 20q gain in the DNA diploid component of aneuploid colorectal carcinomas. Int J Cancer 2007; 120: 2734 – 8.
- 28.
Zhou W, Goodman SN, Galizia G et al. Counting alleles to predict recurrence of early-stage colorectal cancers. Lancet 2002; 359: 219–25.
- 29.
Jen J, Kim H, Piantadosi S et al. Allelic loss of chromosome 18q and prognosis in colorectal cancer. N Engl J Med 1994; 331: 213– 21.
- 30.
Offerhaus GJ, De Feyter EP, Cornelisse CJ et al. The relationship of DNA aneuploidy to molecular genetic alterations in colorectal carcinoma. Gastroenterology 1992; 102: 1612 – 9.
- 31.
Søreide K, Janssen EA, Søiland H et al. Microsatellite instability in colorectal cancer. Br J Surg 2006; 93: 395 – 406.
- 32.
Søreide K. Molecular testing for microsatellite instability and DNA mismatch repair defects in hereditary and sporadic colorectal cancers – ready for prime time? Tumor Biol 2007; akseptert for publisering.
- 33.
Kim GP, Colangelo LH, Wieand HS et al. Prognostic and predictive roles of high-degree microsatellite instability in colon cancer: a National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project collaborative study. J Clin Oncol 2007; 25: 767 – 72.
- 34.
Chang EY, Dorsey PB, Johnson N et al. A prospective analysis of microsatellite instability as a molecular marker in colorectal cancer. Am J Surg 2006; 191: 646 – 51.
- 35.
Benatti P, Gafa R, Barana D et al. Microsatellite instability and colorectal cancer prognosis. Clin Cancer Res 2005; 11: 8332 – 40.
- 36.
Wong JJ, Hawkins NJ, Ward RL. Colorectal cancer: a model for epigenetic tumorigenesis. Gut 2007; 56: 140 – 8.
- 37.
Baylin SB, Ohm JE. Epigenetic gene silencing in cancer – a mechanism for early oncogenic pathway addiction? Nat Rev Cancer 2006; 6: 107– 16.
- 38.
Castellvi-Bel S, Castells A. CpG island methylator phenotype: the third way of colorectal carcinogenesis. Gastroenterology 2007; 132: 1184 –5.
- 39.
Weisenberger DJ, Siegmund KD, Campan M et al. CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer. Nat Genet 2006; 38: 787 – 93.
- 40.
Goel A, Nagasaka T, Arnold CN et al. The CpG island methylator phenotype and chromosomal instability are inversely correlated in sporadic colorectal cancer. Gastroenterology 2007; 132: 127 – 38.
- 41.
Derks S, Postma C, Moerkerk PT et al. Promoter methylation precedes chromosomal alterations in colorectal cancer development. Cell Oncol 2006; 28: 247 – 57.
- 42.
Feinberg AP, Ohlsson R, Henikoff S. The epigenetic progenitor origin of human cancer. Nat Rev Genet 2006; 7: 21 –33.
- 43.
Wang Y, Jatkoe T, Zhang Y et al. Gene expression profiles and molecular markers to predict recurrence of Dukes’ B colon cancer. J Clin Oncol 2004; 22: 1564– 71.
- 44.
Watanabe T, Kobunai T, Toda E et al. Distal colorectal cancers with microsatellite instability (MSI) display distinct gene expression profiles that are different from proximal MSI cancers. Cancer Res 2006; 66: 9804– 8.
- 45.
Locker GY, Hamilton S, Harris J et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Oncol 2006; 24: 5313 – 27.
- 46.
Kørner H, Søreide K, Stokkeland PJ et al. Diagnostic accuracy of serum-carcinoembryonic antigen in recurrent colorectal cancer: a receiver operating characteristic curve analysis. Ann Surg Oncol 2007; 14: 417 – 423.