En 34 år gammel mann ble innlagt i sykehus etter å ha vært plaget med slapphet i åtte uker. Det er uklart om han hadde feber i denne perioden. Fire uker før innleggelsen hadde han oppsøkt lege, som forskrev amoksicillin 500 mg tre ganger daglig i ti dager. Dette førte til bedring av symptomene og serumkonsentrasjon av C-reaktivt protein falt fra 96 mg/l til 15 mg/l. Da han på ny oppsøkte lege etter ytterligere fire uker på grunn av økende slapphet, vekttap, brystsmerter og et par episoder med dobbeltsyn, ble han innlagt i lokalsykehuset.
Ved innleggelsen var blodtrykket 147/68 mm Hg, hjertefrekvensen regelmessig med 76 slag/minutt og kroppstemperaturen var 37,2 ºC. C-reaktivt protein var 40 mg/l, senkningsreaksjon 40 mm og alkalisk fosfatase var 354 U/l. En rekke blodkulturer viste ingen oppvekst. EKG viste sinusrytme. Det fremkom at han 15 år tidligere hadde fått påvist lekkasje i aortaklaffen, og dessuten at han i lengre tid hadde hatt problemer med infeksjon i tennene.
Slapphet, vekttap og forhøyede inflammasjonsmarkører er uspesifikke symptomer som gir liten differensialdiagnostisk veiledning. Aortaklafflekkasje disponerer imidlertid for endokarditt og infeksjon i tannrøtter er en typisk årsak til bakteriemi. Det var derfor grunn til å undersøke pasienten raskt med ekkokardiografi.
Transtorakal og transøsofageal ekkokardiografi viste bikuspid aortaklaff med lekkasje av moderat grad. Venstre ventrikkel var noe utvidet med god pumpefunksjon. På atriesiden av fremre mitralseil ble det påvist en tumorliknende oppfylling. Sentralt i denne oppfyllingen var det to hulrom. Høyre hjertehalvdel var normal.
Fire dager etter innleggelsen i lokalsykehus ble han overflyttet regionsykehuset med spørsmål om infeksiøs endokarditt på mitralklaffen. Ved overflyttingen var han afebril og i relativt god allmenntilstand. Over hjertet hørtes en diastolisk dusjlyd. Han hadde ingen petekkier eller andre ytre tegn til perifere embolier. C-reaktivt protein var 17 mg/l, hvite blodceller 9,7 · 10⁹/l og hemoglobin 13,2 g/100 ml. En rekke blodkulturer viste fortsatt ingen oppvekst. Serologiske undersøkelser var negative med henblikk på Mycoplasma og Chlamydia.
Ved sterk mistanke om infeksiøs endokarditt, men uten oppvekst av bakterier i blodkulturer må man vurdere om blodkulturene er tatt forskriftsmessig. Blodet må dessuten dyrkes med tanke på mikrober som ikke lar seg dyrke på vanlige medier, og i lengre tid enn vanlig med tanke på mikrober som vokser sakte. Mistanke om endokarditt må derfor påføres rekvisisjonen. Det må også vurderes om endokarditt kan være forårsaket av mikrober som ikke lar seg dyrke. Ved negative blodkulturer er det også viktig å utelukke tilstander som kan simulere infeksiøs endokarditt, som for eksempel kollagenoser, revmatisk feber, tuberkulose eller Libman-Sacks’ endokarditt. Imidlertid hadde vår pasient en sykehistorie som først og fremst tydet på en infeksiøs årsak.
Antibiotikakurer tidlig i forløpet av en infeksiøs endokarditt, uten at det er tatt blodkulturer, anses som den vanligste årsak til manglende vekst i blodkulturer tatt senere i forløpet. Vår pasient hadde sterk sykdomsfølelse i forbindelse med behandlingen med amoksicillin før innleggelse i sykehus, og følte seg betydelig bedre etterpå. Det er derfor mulig at pasienten har hatt en infeksjon med penicillinfølsomme mikrober som ble utryddet i forbindelse med penicillinbehandling.
EKG, røntgen thorax og ultralydundersøkelse av lever, galle, pancreas og nyrer gav normale resultater. Røntgen av kjevene viste rotabscess, og en tann ble fjernet. MR av hjernen viste flere mindre lesjoner, tolket som infarkter. Transtorakal og transøsofageal ekkokardiografi bekreftet at aortaklaffen var bikuspid. Aortalekkasjen ble vurdert som stor. Det var en normalt fungerende mitralklaff med en oppfylling på atriesiden av fremre seil med to hulrom og en påleiring på toppen (fig 1). Det kunne ikke utelukkes at det var blodstrøm inne i hulrommene (fig 2). Det ble også påvist en innbukning i aortaroten som gav mistanke om et abscesshulrom (fig 3). MR av hjertet bekreftet funnene, men gav ingen ytterligere opplysninger.

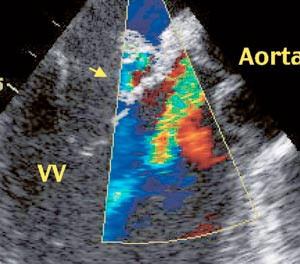
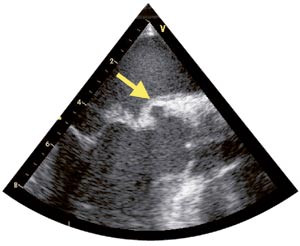
Vår pasient hadde en oppfylling på fremre mitralseil som først og fremst ble oppfattet som en vegetasjon. Usikkerheten berodde på at oppfyllingen ikke hadde en oscillerende karakter som er typisk for vegetasjoner. Derfor ble også andre differensialdiagnoser som myksom og fibroelastom vurdert. Hulrommene i vegetasjonen ble umiddelbart mistenkt for å være abscesser (fig 1). Imidlertid bør man skille mellom ekte abscesser og abscesshulrom. Ekte abscesser kan være vanskelige å oppdage ved ekkokardiografi siden de inneholder puss og derfor gir samme ekko som myokard. De forekommer mye sjeldnere enn abscesshulrom og medfører sannsynligvis dårligere prognose, muligens på grunn av manglende blodforsyning med vanskelig tilgjengelighet for antibiotika.
Abscesshulrom kan tenkes å være pseudoaneurismer, forårsaket av en kombinasjon av infeksjon og hemodynamiske forhold. Bakgrunnen for denne hypotesen er at slike hulrom sjelden forekommer i lavtrykkskamre, som venstre atrium og høyre hjertehalvdel. Hos vår pasient bør hulrommet i aortaroten og hulrommene i «vegetasjonen» betegnes som abscesshulrom og ikke som abscesser, siden det ikke var tegn til puss.
14 dager etter innleggelsen i regionsykehuset kunne den ekkokardiografiske kontrollen tyde på forverring. Det ble derfor bestemt å operere pasienten. Bortsett fra amoksicillin som han fikk av allmennpraktiserende lege, var han uten antibiotika inntil dagen før operasjonen da det ble startet intravenøs behandling med benzylpenicillin, dikloksacillin og gentamicin. Mitralklaffen og aortaklaffen ble erstattet med mekaniske hjerteklaffproteser.
Kirurgisk intervensjon ved mistanke om endokarditt må overveies ved komplikasjoner som medfører hemodynamisk ustabilitet, men også ved manglende respons på antibiotika, ved tegn til abscess, og ved fare for gjentatte embolier. Indikasjon for operativ behandling av vår pasient var mistanke om abscess på mitralklaffen og i aortaroten, fare for residiverende embolier og stor aortaklafflekkasje.
Under operasjonen viste inspeksjon av aortaklaffen betennelsesforandringer som bredte seg som et teppe helt fra aortaroten og nedover på hele fremre mitralseils ventrikkelside. Det forelå dessuten enkelte mindre vegetasjoner på aortaklaffen og to små abscesshulrom i aortaroten. Ved inspeksjon av mitralklaffen fant man at den ca. 2,5 cm store oppfyllingen på mitralklaffen hadde bred basis med gjennomvekst av klaffeseilet, og den hadde en glatt overflate.
Histologisk undersøkelse av det eksiderte vevet viste betennelsesforandringer som ved infeksiøs endokarditt (fig 4), men det var ikke tegn til bakterier, verken ved dyrking eller mikroskopi. Polymerasekjedereaksjon av det eksiderte vevet var negativ med henblikk på Mycoplasma og Chlamydia. Myksom og andre tumorer kunne utelukkes.
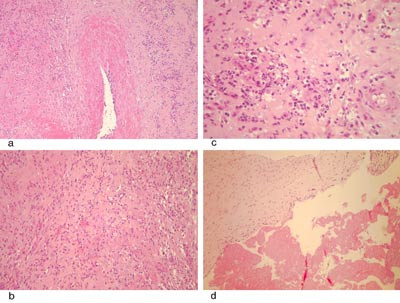
Selv om man kan stille diagnosen endokarditt med kliniske kriterier, er det klargjørende å få den bekreftet ved et eventuelt kirurgisk inngrep. Den makroskopiske vurderingen i forbindelse med operasjonen, samt de mikrobiologiske analysene og de histologiske undersøkelsene av det eksiderte vevet, skal bekrefte diagnosen.
Den histologiske undersøkelsen kunne ikke utelukke vaskulitt. Det var imidlertid ingen opphopning av revmatisk sykdom i familien og verken sykehistorien, kliniske undersøkelser eller immunologiske tester støttet den hypotesen.
Postoperativt utviklet det seg en betydelig mengde perikardvæske uten at pasienten viste tegn til alvorlig tamponade. Det ble tappet 700 ml blodig væske 15 dager etter operasjonen. Perikardvæsken gjendannet seg ikke og han ble flyttet tilbake til lokalsykehuset i relativt god allmenntilstand 35 dager etter innleggelsen. Total behandlingstid for benzylpenicillin og gentamicin var seks uker. Behandlingen med dikloksacillin ble stoppet etter en uke. Etter seks måneders oppfølging er han i god form uten symptomer.
Diskusjon
Infeksiøs endokarditt er infeksjon av endokard, vanligvis på hjerteklaffene, med danning av en såkalt vegetasjon. Redusert immunforsvar og defekter i hjerteveggens endotel bidrar til at bakterier kan slå seg ned og vokse på hjerteklaffene. Streptococcus viridans er den vanligste mikroben ved endokarditt, men stafylokokker forekommer hyppig hos stoffmisbrukere og ved kunstig hjerteklaff. I Norge forekommer over 200 tilfeller av endokarditt årlig. Overlevelsen avhenger av mikrobe, samt tidlig diagnose og behandling.
Diagnose
Duke-kriteriene (1, 2) er et viktig hjelpemiddel i diagnosen av infeksiøs endokarditt (ramme 1). Kriteriene vektlegger funn ved ekkokardiografi.
Duke-kriteriene (modifisert etter Durack og medarbeidere (2))
En sikker diagnose må tilfredsstille enten to hovedkriterier, ett hovedkriterium og tre bikriterier, eller fem bikriterier
Diagnosen avvises dersom infeksiøs endokarditt ikke kan bekreftes ved autopsi eller kirurgi eller dersom sykdomstilstanden bedres raskt ved kortvarig antibiotikabehandling
Endokarditt er fortsatt en mulighet dersom diagnosen ikke kan avvises, men samtidig ikke tilfredsstiller kriteriene for å være sikker
Hovedkriterium – mikrobiologi
-
A. Typiske
bakterier i to blodkulturer (Streptococcus viridans, Streptococcus bovis, Staphylococcus aureus, HACEK-gruppen, enterokokker) med ikke påvist primærfokus.
-
B. Mikroorganismer
i >= 2 blodkulturer > 12 timer etter hverandre eller vekst i tre av tre eller i tre av fire blodkulturer
Hovedkriterium – ekkokardiografi
-
A. Typiske
ekkokardiografiske funn (oscillerende intrakardial masse på klaffer eller støtteapparat), abscess og nyoppstått partiell løsning av klaffeprotese
-
B. Ny
bilyd (økning eller forandring av kjent bilyd er ikke tilstrekkelig)
Bikriterier
Predisponerende hjertesykdom eller intravenøst stoffmisbruk
Feber >= 38 ºC
Vaskulære funn: arteriell embolus, septisk lungeinfarkt, mykotisk aneurisme, hjerneblødning, konjunktival blødning og Janeways lesjoner
Immunfenomen: glomerulonefritt, Oslers knuter, Roths flekker og positiv revmatoid faktor
Positive blodkulturer som ikke oppfyller hovedkriteriene (vekst av andre bakterier enn de nevnt under hovedkriterier)
Ekkokardiografi: unormale, men ikke diagnostiske funn
Vår pasient hadde både vegetasjon på mitralklaffen og abscesshulrom i aortaroten. Begge disse funn kunne representere et hovedkriterium (1). Påvisning av abscesshulrom (3) har høy spesifisitet og bør rangeres høyere enn vegetasjonen, som da kan klassifiseres som et bikriterium.
Av bikriterier for øvrig hadde han predisponerende hjertesykdom i form av aortaklafflekkasje, og vi tolker episodene med dobbeltsyn og tegn til infarkt ved MR-undersøkelse av hjernen, som vaskulære fenomener. Et mulig fjerde bikriterium baseres på mistanken om feber tidlig i sykdomsforløpet da han var sengeliggende og slapp i flere dager, men uten å måle kroppstemperaturen. Det ble imidlertid ikke registrert feber under oppholdene i sykehus.
Vår pasient fikk ikke påvist mikroorgansimer, verken i blodkulturer eller med andre metoder, og mangler derfor et hovedkriterium. Det var likevel mulig å stille diagnosen sikker infeksiøs endokarditt på bakgrunn av ett hovedkriterium og 3 – 4 bikriterier (ramme 1).
Kulturnegativ endokarditt er aktiv infeksjon av endokard uten oppvekst i blodkulturer (1, 4, 5). Stor variasjon i prevalenstall (5 – 30 %) kan tyde på at denne tilstanden er vanskelig å definere og også vanskelig å diagnostisere. Duke-kriteriene har her nødvendigvis lav følsomhet siden det mangler et hovedkriterium. For å bedre følsomheten er det foreslått å øke vektlegging av mikroorganismer som sjeldnere forårsaker endokarditt (1, 4, 5). Både Bartonella og Coxiella burnetii er hyppigere årsak til endokarditt enn tidligere antatt, men disse mikrobene er lite aktuelle i Norge. Serologiske tester kan gi en pekepinn på om Legionella, Chlamydia psittaci og Mycoplasma kan være årsak til endokarditt.
Studier som har vist spesielt lav følsomhet ved bruk av Duke-kriteriene ved kulturnegativ endokarditt er til dels basert på eldre pasientmaterialer, der det hovedsakelig er anvendt transtorakal ekkokardiografi (6). Selv om bruk av denne undersøkelsesmetoden alene kan forsvares ved lav sannsynlighet for endokarditt, anbefales transøsofageal ekkokardiografi i tilfeller med høyere sannsynlighet og spesielt ved mistanke om komplikasjoner (1). For eksempel kunne abscesshulrommet i aortaroten hos vår pasient vanskelig påvises uten bruk av transøsofageal tilgang.
Behandling
Antibiotikabehandlingen av kulturnegativ endokarditt er angitt noe forskjellig. Benzylpenicillin og gentamicin er et godt førstevalg dersom det ikke er mistanke om spesiell etiologi (7).
Indikasjon for kirurgi foreligger først og fremst ved hemodynamisk ustabilitet, ved tegn på dyp infeksjon (abscesser eller abscesshulrom) og ved forekomst av vegetasjoner som kan gi opphav til embolisering. Flere studier har vist at tidlig kirurgisk intervensjon ved slike komplikasjoner bedrer prognosen (1).
Histologi
Den histologiske undersøkelsen av det eksiderte vevet hos vår pasient viste en betennelsesprosess som kunne passe med infeksiøs endokarditt (fig 4), men uten at det ble påvist bakterier ved dyrking eller mikroskopi. Det var en viss mulighet for vaskulitt, men denne hypotesen lot seg ikke bekrefte med tilleggsundersøkelser. Resultatet av de makroskopiske og mikroskopiske undersøkelsene av det eksiderte vevet gir derfor grunnlag for å tolke tilstanden som infeksiøs endokarditt.
Konklusjon
Infeksiøs endokarditt må mistenkes ved feber og redusert allmenntilstand hos personer med predisponerende hjertesykdom. Klinikken kan være svært varierende (8). Duke-kriteriene er et viktig diagnostisk hjelpemiddel, men følsomheten er redusert ved manglende oppvekst i blodkulturer. I slike tilfeller er ekkokardiografisk undersøkelse ekstra viktig.
Oppgitte interessekonflikter: Ingen
Oppgitte interessekonflikter: Ingen
- 1.
Bayer AS, Bolger AF, Taubert KA et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936 – 48.
- 2.
Durack DT, Lukes AS, Bright DK. New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Duke endocarditis service. Am J Med 1994; 96: 200 – 9.
- 3.
Tingleff J, Egeblad H, Gotzsche CO et al. Perivalvular cavities in endocarditis: abscesses versus pseudoaneurysms? A transesophageal Doppler echocardiographic study in 118 patients with endocarditis. Am Heart J 1995; 130: 93 – 100.
- 4.
Kupferwasser LI, Bayer AS. Update on culture-negative endocarditis. Curr Clin Top Infect Dis 2000; 20: 113 – 33.
- 5.
Naber CK, Erbel R. Diagnosis of culture negative endocarditis: novel strategies to prove the suspect guilty. Heart 2003; 89: 241 – 3.
- 6.
Lamas CC, Eykyn SJ. Blood culture negative endocarditis: analysis of 63 cases presenting over 25 years. Heart 2003; 89: 258 – 62.
- 7.
Sjursen H. Antibiotikabehandling ved infeksiøs endokarditt Tidsskr Nor Lægeforen 2001; 121: 3300 – 5.
- 8.
Provan SA, Kvarenes HW, Gerlyng P et al. Endokardittens mange ansikter Tidsskr Nor Lægeforen 2004; 124: 1788 – 90.
- 9.
Durack DT, Lukes AS, Bright DK. New criteria for diagnosis of infective endocarditis. Am J Med 1994; 96: 200 – 9.
- 10.
Sjursen H. Antibiotikabehandling ved infeksiøs endokarditt Tidsskr Nor Lægeforen 2001; 121: 3300 – 5.
- 11.
Brubakk O, Bruun JN, Hovig B et al. Antibiotikaprofylakse mot bakteriell endokarditt. Tidsskr Nor Lægeforen 1992; 112: 466 – 71.
- 12.
Provan SA, Kvarenes HW, Gerlyng P et al. Endokardittens mange ansikter Tidsskr Nor Lægeforen 2004; 124: 1788 – 90
- 13.
Soma J, Henriksen AZ, Viset T et al. 34-årig mann med slapphet, vekttap, dobbeltsyn og bilyd over hjertet Tidsskr Nor Lægeforen 2004; 124: 1791 – 4.