Background
. In some countries, heroin is widely used as an analgesic agent.
Material and methods
. The literature describing the history, pharmacology and analgesic use of heroin was reviewed.
Results
. Heroin is a semi-synthetic morphine derivative. A century ago it was considered a panacea with numerous indications. Today it is best known as a drug of abuse, but is still in use as an analgesic. Most studies that compare heroin with other analgesics have methodological shortcomings; however, they generally indicate that heroin has a clinical effect not very different from morphine. An better aqueous solubility as compared to morphine may in some situations be advantageous. Because of a proposed incomplete cross-tolerance between heroin and other opioid analgesics, it may be used if the patient shows sub-therapeutic response to first-line opioids.
Interpretation
. Although not well documented, heroin appears to be an effective analgesic with certain properties different from those of morphine. It may be of clinical value in conditions with acute and/or terminal pain.
Heroin (diamorfin, diacetylmorfin) ble første gang syntetisert i 1874 av C.R. Wright ved St. Mary’s Hospital i London. I 1898 kom den første publikasjonen om heroin, som omhandlet bruk ved tuberkulose (1). Senere samme år kom heroin i salg, og stoffet ble de neste årene markedsført som et potent og sikkert hostedempende medikament (fig 1). I løpet av kort tid fikk heroin status som et vidundermiddel med et stort antall lokale og systemiske indikasjoner, som inkluderte migrene, multippel sklerose, epilepsi og nymfomani. Legemidlet fikk sitt navn fordi det ble betraktet som en «heroisk» farmakologisk nyvinning (2) – (4).

Man ble etter hvert oppmerksom på den vanedannende effekten av midlet. I USA ble heroinproduksjonen forbudt i 1924, og på denne tiden kom det også restriksjoner i andre vestlige land (4).
De eneste vestlige land som i dag har godkjent heroin for medisinsk bruk er Storbritannia, Canada, Belgia, Island, Malta, Nederland og Sveits (4). I Norge har ingen heroinpreparater markedsføringstillatelse, men de kan forskrives på registreringsfritak. Fra Nasjonalt folkehelseinstitutt opplyses det at det i 2000 og 2001 ikke ble solgt heroin til medisinsk bruk i Norge (H.S. Blix, personlig meddelelse).
Kjemi og farmakologi
Heroin er morfin med acetylsubstitusjoner i 3- og 6-posisjon (fig 2). Acetylgruppene gjør heroinmolekylet om lag 200 ganger mer fettløselig enn morfin. Heroin kan derfor krysse blod-hjerne-barrieren raskere enn de fleste andre opioider, og flere ganger så raskt som morfin (5). Dette kan forklare hvorfor nettopp heroin foretrekkes blant opioidmisbrukere. Saltformen heroinklorid er dessuten om lag 15 ganger mer vannløselig enn morfinklorid, slik at store doser kan konsentreres i små væskevolumer (6). Dette er en fordel ved injeksjoner (7) så vel som ved peroral administrasjon av miksturer. I Storbritannia er heroin førstevalgspreparat ved subkutan administrasjon av opioider (8), og ved intranasal administrasjon er det velegnet, siden det både kan administreres i små volumer og raskt og effektivt tas opp gjennom neseslimhinnen (9).
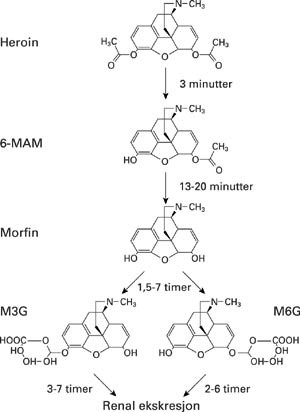
Heroin har ikke evnen til å binde seg til opioidreseptorer, men brytes raskt ned til tre aktive metabolitter: 6-monoacetylmorfin (6-MAM), morfin og morfin-6-glukuronid (M6G) (fig 2). Disse metabolittene er agonister på opioidreseptoren OP3 (µ, MOR/MOP), som formidler mesteparten av opioidenes analgetiske effekt (6). Ved systemisk administrasjon er M6G dobbelt så potent som morfin, mens M6G gitt intratekalt (spinalt) er over 100 ganger mer potent enn morfin (10). Klinisk erfaring tilsier at det foreligger inkomplett krysstoleranse mellom heroin og morfin, noe som også er vist eksperimentelt (11). Dette betyr at man kan bytte fra morfin til heroin i tilfeller hvor det er oppstått toleranseutvikling og dermed oppnå fornyet analgetisk effekt. En molekylærbiologisk forklaring på fenomenet kan være at vi uttrykker forskjellige isoformer av OP₃-reseptoren som de ulike agonistene har forskjellig affinitet for. Så langt er det med molekylærbiologiske metoder påvist sju distinkt forskjellige undergrupper av OP₃-reseptorer som binder forskjellige agonister med varierende affinitet (11).
Heroin absorberes komplett ved peroral administrasjon (12), men metaboliseres fullstendig til 6-MAM og videre til morfin under sin første passasje gjennom leveren (13). Morfin konjugeres videre til morfin-3-glukuronid (M3G) og M6G i reaksjoner med glukuronsyre (fig 2) (14). Heroin skilles i hovedsak ut som glukuroniderte morfinkonjugater i urin (14).
Klinisk anvendelse
I Storbritannia benyttes heroin terapeutisk på linje med andre sterke opioidanalgetika. Vi fant 43 publiserte studier hvor man har forsøkt å dokumentere den kliniske effekten av heroin. I vår gjennomgang av disse studiene ekskluderte vi alle som ikke var prospektive, randomiserte og blindede, samt studier der heroin og det analgetikum som heroin sammenliknes med, ikke var gitt i antatt ekvianalgetiske doser. Videre ekskluderte vi studier der heroin var sammenliknet med analgetika som ikke kan kalles referansesubstanser ved de aktuelle tilstandene. Etter sorteringen satt vi igjen med seks publikasjoner (tab 1) (7, 15) – (19) som er diskutert i det følgende. To åpne studier (9, 20) som omhandler bruk av heroin hos barn er også omtalt. En liste over de 35 eksluderte studiene kan fås ved henvendelse til forfatterne.
Tabell 1
Oversikt over de viktigste og metodologisk beste randomiserte og dobbeltblindede kliniske studier av virkningen til heroin. Alle omtalte forskjeller er statistisk signifikante
| Referanse |
Legemiddel, dosering |
Materiale |
Resultat |
| 7 |
Heroin versus morfin gitt som mikstur (overkrysningsstudie; doseratio 1 : 1,5) |
146 kreftpasienter |
Heroin gav dårligere analgesi og mer dysfori enn morfin hos menn |
| 15 |
Heroin 5 mg versus buprenorfin 0,3 mg intravenøst |
120 pasienter med mistenkt hjerteinfarkt |
Heroin gav raskere effekt enn buprenorfin |
| 16 |
Heroin versus morfin intravenøst som pasientkontrollert analgesi |
40 ortopediske pasienter |
Dosebehovet for morfin var dobbelt så stort som for heroin. Ingen forskjeller i effekt/bivirkninger |
| 17 |
Heroin 5 mg eller 7,5 mg versus petidin 100 mg eller 150 mg intramuskulært |
133 fødende kvinner |
Heroin gav bedre analgesi, mindre oppkast og høyere apgarskåre enn petidin |
| 18 |
Intratekalt bupivakain + heroin 0,125 mg, 0,25 mg, 0,375 mg eller saltvann |
80 kvinner etter keisersnitt |
Heroin gav bedre effekt enn placebo. Bivirkninger, men ikke effekt, økte med økende heroindoser |
| 19 |
Intratekalt bupivakain + heroin 0,2 mg eller morfin 0,2 mg |
40 kvinner etter keisersnitt |
Heroin gav mindre sedasjon og kløe enn morfin. Ingen forskjell i effekt |
Smertelindring ved kreftsykdom
Twycross (7) utførte en overkrysningstudie der han sammenliknet perorale miksturer bestående av heroin eller morfin ved terminale kreftlidelser hos 146 pasienter (tab 1). Dosen ble individuelt bestemt, og det ble benyttet en heroin : morfin doseratio på 1 : 1,5. Forskjeller ble påvist kun hos de mannlige pasientene, som hadde signifikant mer smerte og lavere stemningsleie etter heroin enn etter morfin. Mange forhold ved denne studien er kritikkverdige, men det er likevel den beste som hittil er gjort ved kreftsykdom. Vi har også evaluert to andre studier som på grunn av metodesvakheter ikke refereres. Det er generelt ikke publisert gode studier som muliggjør konklusjoner om heroinbehandling ved kreftsykdom. Særlig savnes studier av behandling ved morfinrefraktære smerter.
Akuttbehandling ved hjerteinfarkt
I Storbritannia har heroin tradisjonelt vært førstevalgspreparat ved mistenkt hjerteinfarkt på grunn av god og raskt innsettende effekt og fravær av hemodynamiske bivirkninger. Hayes og medarbeidere (15) sammenliknet i en studie påstått ekvivalente intravenøse doser av heroin og buprenorfin hos 120 pasienter med mistenkt hjerteinfarkt (tab 1). De fant ingen forskjell i grad av smertelindring eller varighet av effekt, og heller ikke i bivirkningsprofil. Heroin gav bedre smertelindring etter fem minutter, men etter ett kvarter hadde forskjellen jevnet seg ut. En annen studie som omhandler heroin ved hjerteinfarkt er også utført, men er metodologisk inadekvat.
Postoperativ smertelindring
I én metodologisk god studie er effekten av heroin ved postoperativ smerte evaluert. Robinson og medarbeidere (16) sammenliknet dosebehov og bivirkningsprofil av intravenøst heroin og morfin hos 40 pasienter etter innsetting av totalprotese i hoften (tab 1). Heroin 1 mg eller morfin 2 mg ble gjentatte ganger administrert intravenøst som pasientkontrollert analgesi. Det var ingen signifikante forskjeller mellom gruppene når det gjaldt kvalme, sedasjon eller grad av tilfredshet. Vi har evaluert 19 andre studier av heroin ved postoperative smerter. Alle disse ble ekskludert grunnet metodologiske svakheter.
Smertelindring ved fødsel
Én metodologisk god studie omhandler smertelindring med heroin ved vaginal forløsning. Fairlie og medarbeidere (17) sammenliknet intramuskulære injeksjoner av petidin og heroin hos 133 fødende kvinner (tab 1). Kvinnene i heroingruppen fikk signifikant bedre effekt og færre bivirkninger enn kvinnene som fikk petidin, og barnas apgarskåre etter ett minutt var også signifikant høyere i heroingruppen. Petidin er imidlertid ikke det optimale referanseanalgetikum ved fødsler (21). Fire andre studier som evaluerer heroin på denne indikasjonen har metodologiske svakheter som gjør at de ikke omtales.
Det er publisert to metodologisk akseptable studier om heroinadministrasjon ved keisersnitt (tab 1). Kelly og medarbeidere (18) undersøkte dosebehov og bivirkningsprofil av intratekalt bupivakain kombinert med placebo eller økende doser heroin etter elektivt keisersnitt hos 80 kvinner. Husaini & Russell (19) gjorde en undersøkelse hvor de sammenliknet intratekalt bupivakain kombinert med heroin eller morfin hos 40 kvinner etter elektivt keisersnitt. I den førstnevnte studien (18) var det bedre smertelindring hos kvinnene som fikk heroin og bupivakain enn hos dem som fikk placebo og bupivakain. I den andre studien (19) kunne man ikke påvise signifikante forskjeller mellom gruppen som fikk heroin og gruppen som fikk morfin med hensyn til smertelindring, mens grad av sedasjon og kløe var signifikant høyere i morfingruppen. Fem andre studier av heroin på denne indikasjonen har metodemangler som gjør at de ikke omtales.
Smertelindring hos barn
Nylig er det publisert to åpne studier som viser at intranasal heroinadministrasjon kan være en lovende analgesiform hos barn med akutte smerter. Kendall og medarbeidere (20) sammenliknet intranasalt heroin 0,1 mg/kg med intramuskulært morfin 0,2 mg/kg hos 404 barn innlagt for frakturer. Heroin gav signifikant raskere og mer effektiv analgesi, og var forbundet med mindre ubehag. Wilson og medarbeidere (9) sammenliknet også intranasalt heroin 0,1 mg/kg med intramuskulært morfin 0,2 mg/kg hos 58 barn innlagt med mistanke om ekstremitetsfrakturer. Heroin gav signifikant færre bivirkninger, men ikke bedre effekt. Fire andre studier med barn, hvor heroin ble gitt epiduralt, spinalt, intravenøst, intramuskulært eller subkutant, omtales ikke.
Bivirkninger
Frem til 1970-årene ble det antatt at heroin var mer euforiserende og mindre sederende, emetogent og obstiperende enn morfin. Det ble også hevdet at faren for respirasjonshemming og avhengighet var større for heroin (22). Intratekal administrasjon av heroin er imidlertid blitt hevdet å forårsake mindre respirasjonshemming enn morfin, antakelig på grunn av raskere penetrasjon til hjernevev fremfor konveksjon med cerebrospinalvæsken til respirasjonsregulerende sentre (23). Så sent som i 1998 var heroin det mest brukte opioidet ved denne administrasjonsformen i Storbritannia (19). De nevnte antakelsene er i det vesentlige tuftet på klinisk erfaring, og det finnes ikke vitenskapelig dokumentasjon for slike forskjeller mellom heroin og andre opioider når de brukes ved smertetilstander.
Diskusjon
Diskusjonen om hvorvidt heroin fortjener en plass som legemiddel må være basert på en vurdering hvor midlets fordeler veies mot ulempene.
En mulig fordel er at man får enda et medikament for hånden i tilfeller av subterapeutisk respons på tradisjonelle sterke opioider. Dette gjelder enten årsaken er toleranseutvikling etter morfinbehandling eller individuell variasjon i medikamentrespons. Ved behov for å administrere store doser opioider løst i små volumer kan heroin tenkes å være mer velegnet enn dagens primærbehandling. Heroin kan også være godt egnet for intranasal tilførsel, men det bør gjennomføres studier som sammenlikner heroin med andre potente analgetika for intranasal administrasjon, f.eks. fentanyl eller sufentanil.
En potensiell ulempe ved klinisk anvendelse av heroin er avhengighet. Erfaringer fra Storbritannia tyder imidlertid på at heroin ikke gir større fare for avhengighet enn morfin (24), og argumentet er uansett ikke relevant hos pasienter med terminal sykdom. Det er videre spekulert i om en medisinal omsetning av heroin vil kunne gi lekkasjer til illegale miljøer, men denne risikoen kan trolig reduseres ved å begrense forskrivningsretten til relevante medisinske spesialiteter. Faren for apotekran kan tenkes å øke, men erfaringer fra England viser at heroin i så måte ikke utgjør noen større sikkerhetsrisiko enn andre legemidler med avhengighetspotensial (25). Det kan også spekuleres i hvorvidt klinisk anvendelse av heroin kan ha en uheldig signaleffekt ved at det reduserer inntrykket av at heroin er farlig og dermed gir økt rekruttering til heroinmisbruk.
Konklusjon
Forskjellene mellom heroin og morfin er egentlig ikke store. Heroin kan betraktes som en konsentrert og trolig mer rasktvirkende administrasjonsform av morfin, hvor en intermediær metabolitt, 6-MAM, i tillegg muligens kan gi en bedre analgetisk effekt hos pasienter med ervervet morfintoleranse. Flere og bedre kliniske studier må utføres før heroin eventuelt kan få plass i rutinebehandlingen ved smertetilstander.
Interessekonflikter: Ingen
- 1.
Strube G. Mitteilung über therapeutische Versuche mit Heroin. Berl Klin Wochenschr 1898; 45: 993 – 6.
- 2.
Karch SB. The pathology of drug abuse. New York: CRC Press, 1996: 281 – 312.
- 3.
Olsson TI. Heroin: en gang et legalt legemiddel. Kjemi 2001; 1: 18 – 9.
- 4.
de Ridder M. Heroin: new facts about an old myth. J Psychoactive Drugs 1994; 26: 65 – 8.
- 5.
Oldendorf WH, Hyman S, Braun L, Oldendorf SZ. Blood brain barrier: penetration of morphine, codeine, heroin, and methadone after carotid injection. Science 1972; 178: 984 – 6.
- 6.
Scott DB. Diamorphine: its chemistry, pharmacology and clinical use. Cambridge: Woodhead–Faulkner, 1988.
- 7.
Twycross RG. Choice of strong analgesic in terminal cancer: diamorphine or morphine? Pain 1977; 3: 93 – 104.
- 8.
MacConnachie AM. Analgesics in the management of chronic pain. Part five: step 3 parenteral analgesic drug therapy. Intensive Crit Care Nurs 1999; 15: 58 – 60.
- 9.
Wilson JA, Kendall JM, Cornelius P. Intranasal diamorphine for pediatric analgesia: assessment of safety and efficacy. J Emerg Med 1997; 14: 70 – 2.
- 10.
Pasternak GW. The pharmacology of mu analgesics: from patients to genes. Neuroscientist 2001; 7: 220 – 31.
- 11.
Pasternak GW. Incomplete cross tolerance and multiple mu opioid reseptors. Trends Pharmacol Sci 2001; 22: 67 – 70.
- 12.
Twycross RG, Fry DE, Willis PD. The alimentary absorption of diamorphine and morphine in man as indicated by urinary excretion. Br J Clin Pharmacol 1974; 1: 491 – 4.
- 13.
Inturrisi CE, Max MB, Foley KM, Schultz M, Shin SU, Houde RW. The pharmacokinetics of heroin in patients with chronic pain. N Engl J Med 1984; 310: 1213 – 7.
- 14.
Aderjan RE, Skopp G. Formation and clearance of active and inactive metabolites of opiates in humans. Ther Drug Monit 1998; 20: 561 – 9.
- 15.
Hayes MJ, Fraser AR, Hampton JR. Randomised trial comparing buprenorphine and diamorphine for chest pain in suspected myocardial infarction. BMJ 1979; 2: 300 – 2.
- 16.
Robinson SL, Rowbotham DJ, Smith G. Morphine compared with diamorphine. A comparison of dose requirements and side-effects after hip surgery. Anaesthesia 1991; 46: 538 – 40.
- 17.
Fairlie FM, Marchall L, Walker JJ, Elbourne D. Intramuscular opioids for maternal pain relief in labour: a randomised controlled trial comparing pethidine with diamorphine. Br J Obstet Gynaecol 1999; 106: 1181 – 7.
- 18.
Kelly MC, Carabine UA, Mirakhur RK. Intrathecal diamorphine for analgesia after Caesarean section. A dose finding study and assessment of side-effects. Anaesthesia 1998; 53: 231 – 7.
- 19.
Husaini SW, Russell IF. Intrathecal diamorphine compared with morphine for postoperative analgesia after Caesarean section under spinal anaesthesia. Br J Anaesth 1998; 81: 135 – 9.
- 20.
Kendall JM, Reeves BC, Latter VS. Multicentre randomised controlled trial of nasal diamorphine for analgesia in children and teenagers with clinical fractures. BMJ 2001; 322: 261 – 5.
- 21.
Dahl V. Medikamentell smertelindring ved fødsel Tidsskr Nor Lægeforen 2002; 122: 1688 – 90.
- 22.
Lewis JR. Should heroin be available to treat severe pain? JAMA 1978; 240: 1601 – 2.
- 23.
Reay BA, Semple AJ, Macrae WA, MacKenzie N, Grant IS. Low-dose intrathecal diamorphine analgesia following major orthopaedic surgery. Br J Anaesth 1989; 62: 248 – 52.
- 24.
Merskey H. Diamorphine (heroin) and cancer pain. Can Med Assoc J 1983; 129: 931 – 2.
- 25.
Mondzac AM. In defence of the reintroduction of heroin into American medical practice and H.R. 5290 – the Compassionate Pain Relief Act. N Engl J Med 1984; 311: 532 – 5.