Background.
Hurler’s syndrome is a rare congenital metabolic disorder and is inevitably lethal when untreated. The presenting symptoms are usually vague, resembling those found in otherwise healthy children.
Material and methods.
We present a patient with Hurler’s syndrome and discuss the unspecific clinical signs and symptoms seen in these patients based on a review of relevant literature.
Results.
A two-months-old infant boy was operated for a rightsided inguinal hernia. The anaesthesiologist had difficulty intubating the patient. During the following months the patient had a severe allergic reaction to vaccination, chronic rhinitis with recurrent upper airway infections, and diarrhoea and vomiting. Eventually, failure to gain weight, and psychomotoric delay led to a thorough clinical investigation. Extensive X-ray diagnostics and analysis of urine and serum concluded with Hurler’s syndrome.
Interpretation:
Clinical vigilance is needed in the diagnosis of Hurler’s syndrome. Early symptoms, such as rhinitis and hernia, are vague and unspecific. Radiological features, such as broad costae or gibbus, are helpful in obtaining the diagnosis. Decreased level of a-L-iduronidase in serum confirms the diagnosis of Hurler’s syndrome. Patients tend to be treated symptomatically before the eventual diagnosis of this syndrome.
Tabell 1
En rekke mukopolysakkaridoser er beskrevet, hvorav Hurlers syndrom er den vanligste. Hurlers syndrom manifesteres tidligst, er den raskest progredierende og har den alvorligste prognosen. Alle arves autosomalt recessivt, utenom Hunters syndrom som er kjønnsbundet. Tallene er hentet fra Meikle og medarbeidere (3)
| Syndrom |
Type |
Enzymmangel |
Arvegang |
Insidens |
| Hurler (Hurler-Scheie) (Scheie) |
MPS I (moderat form) (mild form) |
a-iduronidase (IDUA) |
Autosomalt recessiv |
1 : 111 000 |
| Hunter |
MPS II |
Iduronat-2-sulfatase |
X-kromosomal |
1 : 162 000 |
| Sanfilippo |
MPS III A, B, C, D |
A) Heparan N-sulfataseB) a-acetyl glukosaminidase C) Acetyl CoA: a-glukosaminid N-acetyltransferase D) N-acetylgalaktosamin-6-sulfatase |
Autosomalt recessiv |
A) 1 : 128 000 B) 1 : 235 000 C) 1 : 1 407 000D) 1 : 1 056 000 |
| Morquio |
MPS IV A, B |
a-acetyl glukosaminidase |
Autosomalt recessiv |
1 : 201 000 |
| Maroteaux-Lamy |
MPS VI |
Arylsulfatase B |
Autosomalt recessiv |
1 : 248 000 |
| Sly |
MPS VII |
b-glukuronidase |
Autosomalt recessiv |
1 : 2 111 000 |
| Multippel sulfatasemangel |
– |
Ulike sulfataser |
Autosomalt recessiv |
1 : 1 407 000 |
Hurlers syndrom er en sjelden, metabolsk sykdom som presenterer seg gradvis fra fødselen av. Årsaken er en genmutasjon i det lysosomale enzymet a-L-iduronidase (IDUA). Sterk reduksjon av eller fullstendig mangel på enzymaktivitet fører til utilstrekkelig lysosomal spalting av glukosaminoglykaner (GAG), som heparansulfat og dermatansulfat (1, 2). På grunn av manglende nedbryting følger en opphopning av delvis nedbrutte substrater i kroppens bindevev. Dette forårsaker defekter og skader i bløtdelsstrukturer, skjelett og sentralnervesystem. Avleiringen fører gradvis til mer fremtredende symptomer. Ubehandlet inntrer død i tidlig alder, ofte som følger av kardiopulmonale komplikasjoner.
Hurlers syndrom følger en autosomalt recessiv arvegang, dvs. foreldre som er bærere av mutasjonen har statistisk sett 1/4 risiko for å få et barn med Hurlers syndrom, som da vil være homozygot for mutasjonen. Insidensen er på ca. 1 per 100 000 levendefødte barn (3). Dette gjør Hurlers syndrom til den hyppigst forekommende mukopolysakkaridosen (tab 1), og den nest vanligste lysosomale avleiringssykdom etter Gauchers sykdom. Ut ifra fødselstall fra Statistisk sentralbyrå (4) kan man anslå at det vil fødes et barn med Hurlers syndrom omtrent annethvert år i Norge.
Hurlers syndrom ble siste gang drøftet i Tidsskriftet i 1974 (5). De siste tiårene er det blitt gjort store fremskritt innen behandling, og en økt innsikt i patogenesen er utviklet. Tidlig i 1980-årene ble ny behandling med beinmargstransplantasjon introdusert (6), og nylig ble resultat av enzymbehandling for mukopolysakkaridose type I (MPS-I) publisert (7). Å stille diagnosen er fortsatt vanskelig ettersom sykdommen er sjelden, screening ikke er rutine, og symptomene kun vage og uspesifikke. Med bakgrunn i en pasienthistorie, supplert med gjennomgang av aktuell litteratur, ønsker vi å illustrere utfordringer rundt tidlig diagnose av Hurlers syndrom. Tidlig diagnose forutsetter at leger i kontakt med barn må tenke på denne tilstanden, selv om den er sjelden.
Pasienten . Gutt som ble født til termin, og som veide 4 250 g. Lengden var 52 cm og hodeomkretsen 35 cm. Moren var førstegangsfødende.
Én måned gammel fikk han diagnostisert et høyresidig lyskebrokk. Han ble innlagt med inkarserert hernie tre uker senere. Brokket reponerte seg spontant. Han ble operert under samme opphold. Anestesilegen registrerte vanskelig maskeventilasjon, og hadde problemer med å plassere tuben. Postoperativt forløp var ukomplisert.
Etter første trippel- og Haemophilus influenzae B-vaksine fem måneder gammel reagerte pasienten med blålig hevelse på ekstremitetene og ble innlagt i barneavdeling. Tilstanden ble oppfattet som en mulig reaktiv vaskulitt på vaksinene. Blodprøvene var da normale, bortsett fra lett eosinofili.
Fra seksmånedersalderen prøvde han Soya Semp etter råd fra helsestasjonen. Morsmelktillegg basert på kumelk førte til brekninger og episoder med blodige, slimete avføringer.
Ved nimånedersalderen ble han utredet ved allergologisk poliklinikk. Han hadde da hatt gjentatte luftveisinfeksjoner og tegn på dårligere trivsel. Lengden var 71 cm og han veide 8,2 kg (25-percentilen, vekt korrelert til høyde). Ved kutantest hadde han kraftig positiv reaksjon for egg, men negativ reaksjon for en rekke andre fødemidler inkludert kumelk. Man antok derfor at han i tillegg til IgE-mediert eggallergi hadde en fødeintoleranse som gav enterokolitt.
De påfølgende fire måneder fikk han, til tross for egg- og kumelkfri kost, økende ernæringsproblemer med hyppige brekninger og store fettholdige avføringer. Han hadde flere feberepisoder og nærmest kronisk grønn snue. Allmenntilstanden var redusert, og den motoriske utviklingen var dårlig . Moren mente at gutten allerede fra sjumånedersalderen hadde stagnert motorisk. Han viste ved ettårskontroll på helsestasjonen fortsatt vekst- og høydestagnasjon. Lengde var 72 cm og vekt 8,6 kg (kun 400 g økning på tre måneder). Han ble henvist til fysioterapeut. Dårlig vekst ble knyttet til hans allerede diagnostiserte allergi og matintoleranse. Foreldrene var nå blitt alvorlig bekymret for guttens helse og utvikling, men følte at plagene hans nærmest ble bagatellisert.
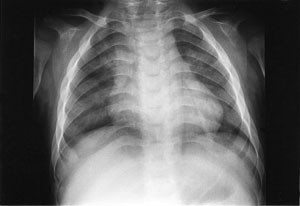
Pasienten ble så 13 måneder gammel innlagt i barneavdeling i forbindelse med ny feberepisode. Ved innleggelsen var han dystrofisk, med stor abdomen, tynne ekstremiteter og slunkne nates. Noe grove ansiktstrekk ble bemerket, men gav ikke umiddelbart videre assosiasjoner. Utredning av malabsorpsjon med tanke på cøliaki ble startet. Metabolsk screening av urin og serum ble rekvirert. Røntgen thorax viste klare lunger og et normalt stort hjerte, men påfallende brede costae (fig 1). Fysioterapeutisk vurdering bemerket en forsinket motorisk utvikling og stive ledd. Øre-nese-hals-undersøkelse viste betydelig nasalstenose og hypertrofiske tonsiller. Foreldrene kunne fortelle om uttalt pustebesvær og sterk snorking om natten, med tendens til pustestopp. Primær malabsorpsjon og cøliaki ble utelukket med serologiske prøver. Ultralyd abdomen viste leverstørrelse i øvre normalområde.
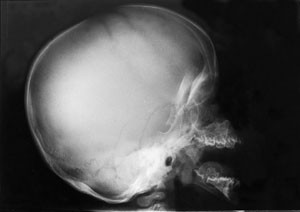
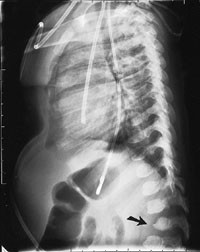
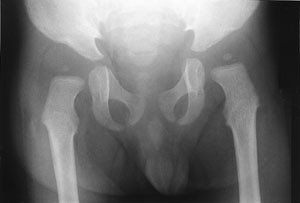
Omfattende radiologisk utredning ble rekvirert. Røntgen av kraniet viste et relativt stort nevrokranium (fig 2) med sannsynlig fortykket calvarium i basale deler. Røntgen av columna viste en kyfotisk knekk på torakolumbalovergangen (fig 3). Røntgen av bekken viste dysplastiske hofter bilateralt (fig 4). Røntgen av håndledd viste forandring av metakarpene. Røntgenologenes endelige konklusjon var dysostosis multiplex, forenlig med Hurlers syndrom. Undersøkelse hos øyelege styrket denne mistanken ytterligere, da det ble funnet bilateral, diffus tilsløring av hornhinnene. Plastisk kirurg bekreftet at det forelå triggerfinger på høyre hånds 4. finger, et typisk funn ved Hurlers syndrom.
Det ble funnet økte mengder av mukopolysakkarider i urinen. Enzymstudier av leukocytter i perifert blod fra pasienten og foreldrene ble utført ved Klinisk-kjemisk avdeling, Rikshospitalet. I prøven fra pasienten ble det ikke påvist a-L-iduronidase (IDUA)-enzymaktivitet. Begge foreldrene hadde lave verdier. Funnene ble ansett å være sikre for diagnosen Hurlers syndrom. Kontakt med Barneklinikken ved Rikshospitalet ble opprettet med tanke på videre kartlegging og behandling. Gutten er siden beinmargstransplantert med moren som donor.
Diskusjon
Den karakteristiske Hurlers fenotype består gjerne av grove ansiktstrekk, forstørret og deformert kranium, liten kropp, sløring på cornea, hepatosplenomegali, klaffefeil på hjertet, fortykket hud, kontraktur i ledd, og hernier (8). Det tidlige sykdomsforløpet er derimot preget av generelle og uspesifikke symptomer, noe som vanskeliggjør tidlig diagnose. Barn med Hurlers syndrom har som regel et normalt forløpende fosterliv, forløses normalt til termin, og viser gjerne normale mål ved fødsel (9). Da behandling med beinmargstransplantasjon er av preventiv art for sykdommens utvikling, er tidlig diagnose av stor betydning for behandlingsresultatet.
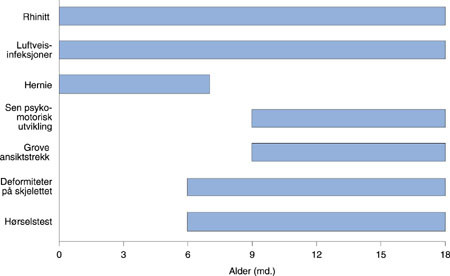
Ettersom Hurlers syndrom er en sjelden sykdom, har man ut i fra et kostnad-nytte-synspunkt ikke kunnet forsvare bruk av screening, til tross for relativt enkle diagnostiske undersøkelsesmetoder av glukosaminoglykaninnhold i urin (10, 11). Prenatal diagnostikk ved hjelp av amniocentese med forhøyede verdier av glukosaminoglykaner og a-L-iduronidasemangel, er utført i svangerskap der det er risiko for Hurlers syndrom (12, 13). Disse diagnostiske metodene er ikke rutine i screening av nyfødte barn. Diagnosen av Hurlers syndrom baserer seg derfor fortsatt på klinisk mistanke (9, 14). I litteraturen finner en beskrivelser av multiple skjelettabnormaliteter, dysostosis multiplex, gibbus og kyfose (14, 15), sløring av cornea (16), glaukom (17), hørselstap (5, 9), kardiomyopati og klaffefeil (1, 18, 19), kronisk obstruksjon av luftveiene (20, 21), vaskulære anomalier og misdannelser (22), hepatosplenomegali og forandringer i sentralnervesystemet (23). Symptomene opptrer typisk i ulike aldersperioder, og korrelerer til dels med sykdommens utvikling (fig 5).
Ingvinal hernie
Lyskebrokk er vanlig hos barn. Man finner en økt insidens av lyskebrokk assosiert med enkelte medfødte sykdommer (24, 25). Vår pasient ble operert for et høyresidig lyskebrokk to måneder gammel. Cleary og medarbeidere rapporterer at 41 % av barn med Hurlers syndrom fikk diagnostisert brokk innen de seks første levemånedene, hvorav ni var lyskebrokk og sju navlebrokk (fig 5). En eldre pasientoversikt fra Harvard (24) viste at 18 av 50 barn med Hurler-Hunters syndrom ble innlagt for lyskebrokk. Ti av disse ble operert, hvorav fem ble oppdaget og operert innen de fire første levemånedene. Også residivfrekvensen er mye høyere enn normalt, og Coran og medarbeidere (24) rapporterte inntil 56 % residiv. Vekstforstyrrelse, kronisk lungesykdom, bindevevssykdommer og feilernæring er av betydning for residiv av barnebrokk (26). Slike tilstander finner man også hos barn med Hurlers syndrom, og de preget også det kliniske bildet til vår pasient. Kunnskap om dette hos kirurgen kan bidra til å gi klinisk mistanke om tilstanden.
Vanskelig anestesi
Hurlers syndrom er sagt å representere det verste luftveisproblemet i barneanestesi. I likhet med andre avleiringssykdommer er barn med Hurlers syndrom overrepresentert når det gjelder luftveisproblemer i forbindelse med generell anestesi (27). Risiko for vanskelig eller mislykket intubering øker med pasientens alder (28), men kan forekomme også tidlig i forløpet, som hos vår pasient. Generelt sett er vanskelig laryngoskopi eller intubering rapportert for 1,5–13 % av anestesiprosedyrer, og mislykket intubering hører til blant anestesirelaterte årsaker til død eller permanent hjerneskade hos pasienter (29). Hos barn med Hurlers syndrom er insidensen av vanskelig intubering beskrevet å være på hele 54 %, og 23 % var mislykket (30). Det er rapportert fatal utgang som følge av postoperative luftveisobstruksjoner hos barn med Hurlers syndrom. Det kan være nødvendig å benytte alternative teknikker for å sikre frie luftveier før, under og etter operasjonen (27). Infeksjoner i øvre luftveier kan være med på å komplisere de allerede vanskelige forholdene.
Øvre luftveisinfeksjoner
Rhinitt er blant de mest vanlige symptomene som registreres innen de tre første levemånedene hos barn med Hurlers syndrom (9). I studien til Cleary & Wraith (9) hadde mer enn halvparten av pasientene øvre luftveisinfeksjoner ved diagnosetidspunktet, og var vanlig i alle aldersgrupper (fig 5). På grunn av forstørrede tonsiller og trange forhold i pharynx er obstruktiv søvnapné et problem hos mange pasienter. Etter behandling med beinmargstransplantasjon forbedrer dette seg betraktelig (21).
Ernæringsproblematikk
Cleary & Wraith (9) rapporterte at sju av 39 barn hadde ernæringsproblemer. Det er derimot ikke gjort klart i artikkelen hvilke type problemer det her dreier seg om. Pasienten vår hadde problemer med å beholde føde, noe som førte til dårlig vektøkning. Han ble vurdert som atopiker og allergiker, noe som ikke har sammenheng med Hurlers syndrom. Hvorvidt vår pasients ernæringsproblemer har sammenheng med de som er rapportert hos andre er vanskelig å si. I pasientserien til Cleary & Wraith (9) var ernæringsproblematikk hyppigere enn hepatosplenomegali (kun tre av 39), som ellers beskrives som et typisk trekk hos barn med Hurlers syndrom.
Symptomer i skjelett- og bindevevsstrukturer
Barn med Hurlers syndrom må ofte gjennomgå kirurgisk behandling for karpaltunnelsyndrom og triggerfinger, også etter beinmargstransplantasjon (31).
Gibbus er et symptom som kan lede mot diagnosen Hurlers syndrom, men da gjerne først etter passerte seks måneder (fig 5). Belmont og medarbeidere (14) bemerker at diagnosen ble stilt spesielt på grunnlag av en torakolumbar kyfose/gibbus, men at pasienten også hadde typiske, grove ansiktstrekk og antydninger til forsinkelse i den motoriske utviklingen. Deres pasient var sju måneder ved diagnosetidspunktet (14). Det er svært vanskelig å stille diagnosen på et tidligere tidspunkt. Median alder ved diagnose oppgis å være mellom ni (9) og 12 måneder (3). Tidligst mulig diagnose er viktig for å kunne oppnå best mulig resultat av behandling med beinmargstransplantasjon.
- 1.
Hinek A, Wilson SE. Impaired elastogenesis in Hurler disease: dermatan sulfate accumulation linked to deficiency in elastin-binding protein and elastic fiber assembly. Am J Pathol 2000; 156: 925 – 38.
- 2.
Russell C, Hendson G, Jevon G, Matlock T, Yu J, Aklujkar M et al. Murine MPS I: insights into the pathogenesis of Hurler syndrome. Clin Genet 1998; 53: 349 – 61.
- 3.
Meikle PJ, Hopwood JJ, Clague AE, Carey WF. Prevalence of lysosomal storage disorders. JAMA 1999; 281: 249 – 54.
- 4.
Statistisk årbok. www.ssb.no/emner/02/02/10/fodte/tab-2000-05-03-10.html (21.1.2001).
- 5.
Høvo G. Hurlers sykdom (Gargoylisme). Tidsskr Nor Lægeforen 1974; 94: 1581 – 3.
- 6.
Hobbs J, Hugh-Jones K, Barrett A, Byrom N, Chambers D, Henry K. Reversal of clinical features of Hurler"s disease and biochemical improvement after treatment by bone marrow transplantation. Lancet 1981; 2: 709 – 12.
- 7.
Kakkis ED, Muenzer J, Tiller GE, Waber L, Belmont J, Passage M et al. Enzyme-replacement therapy in mucopolysaccharidosis I. N Engl J Med 2001; 344: 182 – 8.
- 8.
Spranger J. Mucopolysaccharidoses. I: Rimoin D, Connor J, Pyeritz R, red. Emory and Rimoin"s principles and practice of medical genetics. 3. utg. New York: Churchill Livingstone, 1997: 2071 – 9.
- 9.
Cleary MA, Wraith JE. The presenting features of mucopolysaccharidosis type IH (Hurler syndrome). Acta Paediatr 1995; 84: 337 – 9.
- 10.
Whitley CB, Ridnour MD, Draper KA, Dutton CM, Neglia JP. Diagnostic test for mucopolysaccharidosis. I. Direct method for quantifying excessive urinary glycosaminoglycan excretion. Clin Chem 1989; 35: 374 – 9.
- 11.
Whitley CB, Draper KA, Dutton CM, Brown PA, Severson SL, France LA. Diagnostic test for mucopolysaccharidosis. II. Rapid quantification of glycosaminoglycan in urine samples collected on a paper matrix. Clin Chem 1989; 35: 2074 – 81.
- 12.
Tsvetkova IV, Karpova EA, Voznyi YV, Zolotukhina TV, Biryukov VV, Semyachkina AN. Use of 4-trifluoromethylumbelliferyl-alpha-L-iduronide as a new substrate for detection of alpha-L-iduronidase deficiency in human tissues and for rapid prenatal diagnosis of Hurler disease. J Inherit Metab Dis 1991; 14: 134 – 9.
- 13.
Kleijer WJ, Thompson EJ, Niermeijer MF. Prenatal diagnosis of the Hurler syndrome: report on 40 pregnancies at risk. Prenat Diagn 1983; 3: 179 – 86.
- 14.
Belmont PJ jr., Polly DW jr. Early diagnosis of Hurler"s syndrome with the aid of the identification of the characteristic gibbus deformity. Mil Med 1998; 163: 711 – 4.
- 15.
Tandon V, Williamson JB, Cowie RA, Wraith JE. Spinal problems in mucopolysaccharidosis I (Hurler syndrome). J Bone Joint Surg Br 1996; 78: 938 – 44.
- 16.
Alroy J, Haskins M, Birk DE. Altered corneal stromal matrix organization is associated with mucopolysaccharidosis I, III and VI. Exp Eye Res 1999; 68: 523 – 30.
- 17.
Nowaczyk MJ, Clarke JT, Morin JD. Glaucoma as an early complication of Hurler"s disease. Arch Dis Child 1988; 63: 1091 – 3.
- 18.
Donaldson MD, Pennock CA, Berry PJ, Duncan AW, Cawdery JE, Leonard JV. Hurler syndrome with cardiomyopathy in infancy. J Pediatr 1989; 114: 430 – 2.
- 19.
Johnson GL, Vine DL, Cottrill CM, Noonan JA. Echocardiographic mitral valve deformity in the mucopolysaccharidoses. Pediatrics 1981; 67: 401 – 6.
- 20.
Myer CM. Airway obstruction in Hurler"s syndrome – radiographic features. Int J Pediatr Otorhinolaryngol 1991; 22: 91 – 6.
- 21.
Malone BN, Whitley CB, Duvall AJ, Belani K, Sibley RK, Ramsay NK et al. Resolution of obstructive sleep apnea in Hurler syndrome after bone marrow transplantation. Int J Pediatr Otorhinolaryngol 1988; 15: 23 – 31.
- 22.
Braunlin EA, Krivit W, Burke BA, Rocchini AP, Foker JE, Whitley CB. Radiological case of the month. Coarctation of the aorta in Hurler syndrome. Arch Pediatr Adolesc Med 2000; 154: 841 – 2.
- 23.
Afifi AK, Sato Y, Waziri MH, Bell WE. Computed tomography and magnetic resonance imaging of the brain in Hurler"s disease. J Child Neurol 1990; 5: 235 – 41.
- 24.
Coran AG, Eraklis AJ. Inguinal hernia in the Hurler-Hunter syndrome. Surgery 1967; 61: 302 – 4.
- 25.
Grosfeld JL. Current concepts in inguinal hernia in infants and children. World J Surg 1989; 13: 506 – 15.
- 26.
Grosfeld JL, Minnick K, Shedd F, West KW, Rescorla FJ, Vane DW. Inguinal hernia in children: factors affecting recurrence in 62 cases. J Pediatr Surg 1991; 26: 283 – 7.
- 27.
Moores C, Rogers JG, McKenzie IM, Brown TC. Anaesthesia for children with mucopolysaccharidoses. Anaesth Intensive Care 1996; 24: 459 – 63.
- 28.
Belani KG, Krivit W, Carpenter BLM, Braunlin E, Buckley JJ. Children with mucopolysaccharidosis: perioperative care, morbidity, mortality, and new findings. J Pediatr Surg 1993; 28: 403 – 10.
- 29.
Randell T. Prediction of difficult intubation. Acta Anaesthesiol Scand 1996; 40: 1016 – 23.
- 30.
Walker RW, Darowski M, Morris P, Wraith JE. Anaesthesia and mucopolysacharidosis. A review of airway problems in children. Anaesthesia 1994; 49: 1078 – 84.
- 31.
Van Heest AE, House J, Krivit W, Walker K. Surgical treatment of carpal tunnel syndrome and trigger digits in children with mucopolysaccharide storage disorders. J Hand Surg Am 1998; 23: 236 – 43.